
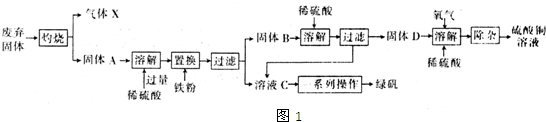
分析 成分为Cu2S和Fe2O3的工业废弃固体灼烧得氧化铜和氧化铁及二氧化硫气体,所以X为SO2,固体A为氧化铜和氧化铁的混合物,A中加入硫酸溶解,再加入过量的铁粉,得硫酸亚溶液和铜固体,过滤后得到溶液C为FeSO4溶液,固体B为铁、铜混合物,B中加入稀硫酸得硫酸亚铁溶液和铜固体,所以固体D为Cu,硫酸亚铁溶液蒸发浓缩、降温结晶可得绿矾晶体,铜与稀硫酸溶液中通入氧气除杂后得硫酸铜溶液,
(1)根据上面的分析可知气体X的化学式;
(2)加入铁粉时,铁与酸、铁离子、铜离子都发生反应;
(3)常温下,FeSO4对铜、氧气、稀硫酸的反应起催化的过程中亚铁离子先被氧化成铁离子,铁离子再氧化铁生成亚铁离子;
(4)除杂时需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,加入的氧化剂及试剂Y要不引入新杂质,据此选择;
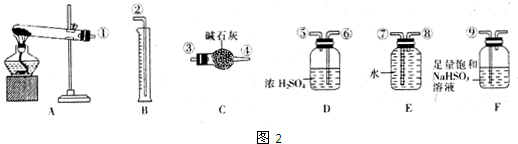
(5)①根据装置图可知仪器名称;
②实验时,根据反应装置、洗气装置、干燥装置、收集装置进行排序;F中装有亚硫酸钠,可以吸收三氧化硫并产生二氧化硫;
③装置C增加的质量为3.84g,即二氧化硫的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,即产生的氧气的物质的量为0.01mol,根据元素守恒可计算出各反应生成物的物质的量之比,据此书写化学方程式;
解答 解:成分为Cu2S和Fe2O3的工业废弃固体灼烧得氧化铜和氧化铁及二氧化硫气体,所以X为SO2,固体A为氧化铜和氧化铁的混合物,A中加入硫酸溶解,再加入过量的铁粉,得硫酸亚溶液和铜固体,过滤后得到溶液C为FeSO4溶液,固体B为铁、铜混合物,B中加入稀硫酸得硫酸亚铁溶液和铜固体,所以固体D为Cu,硫酸亚铁溶液蒸发浓缩、降温结晶可得绿矾晶体,铜与稀硫酸溶液中通入氧气除杂后得硫酸铜溶液,
(1)根据上面的分析可知气体X的化学式为SO2,
故答案为:SO2;
(2)加入铁粉时,铁与酸、铁离子、铜离子都发生反应,反应的离子方程式为Fe+Cu2+=Cu+Fe2+、Fe+2Fe3+=3Fe2+,
故答案为:Fe+Cu2+=Cu+Fe2+、Fe+2Fe3+=3Fe2+;
(3)常温下,FeSO4对铜、氧气、稀硫酸的反应起催化的过程中亚铁离子先被氧化成铁离子,铁离子再氧化铜生成铜离子,反应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu+2Fe3+=2Fe2++Cu2+;
(4)除杂时需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,加入的氧化剂为H2O2,试剂Y为CuO,调节pH值,
故选a;
(5)①根据装置图可知C的名称是干燥管,
故答案为:干燥管;
②实验时,根据反应装置、洗气装置、干燥装置、收集装置进行排序,A是制取气体、B是量取生成氧气体积、C是吸收二氧化硫、D是干燥氧气、E是排水法收集氧气、F吸收三氧化硫,其实验先后顺序是制取气体、除去三氧化硫、吸收水分、吸收二氧化硫、吸收二氧化硫、干燥氧气、收集氧气,所以其排列顺序为①→⑨→⑩→⑥→⑤→③→④→⑧→⑦→②,F中装有亚硫酸钠,可以吸收三氧化硫,使之转化为硫酸,并产生二氧化硫;
故答案为:③;④;⑧;⑦;三氧化硫,使之转化为硫酸,并产生二氧化硫;
③6.4g无水CuSO4,其物质的量为0.04mol,装置C增加的质量为3.84g,即二氧化硫的质量为3.84g,即0.06mol,量筒中水的体积折算成标准状况下气体体积224mL,即产生的氧气的物质的量为0.01mol,每摩尔三氧化硫通过亚硫酸氢钠溶液时产生2mol二氧化硫,设反应中产生三氧化硫为xmol,反应中产生二氧化硫为ymol,则有$\left\{\begin{array}{l}{2x+y=0.06}\\{x+y=0.04}\end{array}\right.$,所以x=0.02,y=0.02,根据铜元素守恒生成的氧化铜的物质的量应为0.04mol,所以反应中CuSO4、CuO、SO3、SO2、O2的物质的量之比为0.04:0.04:0.02:0.02:0.01=4:4:2:2:1,所以反应的方程式为4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO3↑+2SO2↑+O2↑,
故答案为:4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO3↑+2SO2↑+O2↑.
点评 本题考查了物质分离提纯的方法和流程分析应用,侧重于学生的分析能力和实验能力的考查,解答该类题目,注意把握实验原理和操作流程的目的,主要是物质性质的理解,题目难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧根离子浓度变小 | B. | 醋酸的浓度减小 | ||
| C. | 酸性增强,PH变小 | D. | 醋酸根离子浓度变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1.8g18O2中含有NA个质子 | |
| B. | 28gC2H4中含有4NA个C-H键 | |
| C. | 常温下,2.7g铝片投入足量的稀硫酸中,铝失去的电子数为0.3NA | |
| D. | 4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
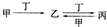 ,下列有关物质的推断正确的是( )
,下列有关物质的推断正确的是( )| A. | 若甲为Al,则丁可能是NaOH溶液 | B. | 若甲为氮气,则丁可能是O2 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为Ca(OH)2溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2=1:3(若c1大于0) | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向正反应方向建立平衡 | |
| C. | c1=0.04 | |
| D. | 0≤c2≤0.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0.则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol.则H2的燃烧热为285.8 kJ/mol | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol.则C(碳)的燃烧热为110.5 kJ/mol | |
| D. | 已知2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol.则该反应的中和热为114.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com