
| A. | 13C与15N有相同的中子数 | B. | 13C的质子数为13 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
分析 A.中子数=质量数-质子数;
B.13C的质子数为6;
C.质子数相同、中子数不同的原子,互为同位素;
D.15N的核外电子数为7,中子数=15-7=8.
解答 解:A.中子数=质量数-质子数,则13C与15N的中子数分别为13-6=7、15-7=8,中子数不同,故A错误;
B.13C的质子数为6,质量数为13,故B错误;
C.15N与14N的质子数均为7、中子数分别为8、7,则15N与14N互为同位素,故C正确;
D.15N的核外电子数为7,中子数=15-7=8,核外电子数与中子数不相同,故D错误;
故选C.
点评 本题考查原子结构与性质,为高频考点,把握原子中的数量关系、核素的表示方法及不同位置数字的意义为解答关键,侧重分析与应用能力的考查,注意原子中数量关系,题目难度不大.


科目:高中化学 来源: 题型:填空题
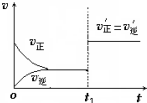 在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).
在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+、Na+、SiO32-、NO3- | B. | 二氧化硫:Na+、NH4+、SO32-、C1- | ||
| C. | 硫化氢:H+、K+、MnO4-、SO42- | D. | 氨气:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com