
| A、K>Na>Li |
| B、Mg2+>Na+>F- |
| C、Na+>Mg2+>Al3+ |
| D、Cl->F->F |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
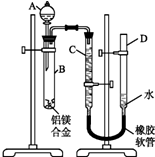 某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200mL 1mol/L的Al2(SO4)3溶液中,Al3+和SO42-离子总数为6.02×1023 | ||
| B、在标准状况下,22.4L Cl2和HCl的混合气体中含有的分子总数为2×6.02×1023 | ||
C、0.1mol
| ||
| D、30g甲醛中含共用电子对总数为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应的实质是电子的转移 |
| B、含最高价元素的化合物均具有强氧化性 |
| C、原子失电子数越多,该元素的金属性就越强 |
| D、强氧化剂和强还原剂混合不一定发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明的水溶液:K+、Na+、SO42-、MnO4- | ||
| B、0.1 mol?L-1 Na2CO3溶液:K+、Ba2+、NO3-、Cl- | ||
| C、PH=2的某溶液:K+、NH4+、Fe2+、NO3- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
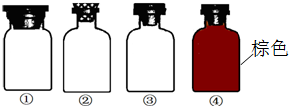 实验室里化学试剂的保存方法是不相同的,如图是常见的一些保存药品的试剂瓶.下列用于存放这些试剂的试剂瓶使用正确的是( )
实验室里化学试剂的保存方法是不相同的,如图是常见的一些保存药品的试剂瓶.下列用于存放这些试剂的试剂瓶使用正确的是( )| A、用①瓶盛装浓硝酸 |
| B、用②瓶盛烧碱溶液 |
| C、用③瓶盛大理石 |
| D、用④瓶盛浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ | ||||
| B、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | ||||
C、用铜做电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何物质中都含有6.02×1023个分子 |
| B、0.012kg 12C中含有约6.02×1023 NA个碳原子 |
| C、1mol水中含有1 mol氢分子和1 mol氧原子 |
| D、1mol H+中含有H+数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2A+3B═3C+3D |
| B、2A+3B═2C+3D |
| C、3A+2B═3C+2D |
| D、3A+2B═2C+3D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com