
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ�ȣ�mol•L-1�� | 0.44 | 0.6 | 0.6 |
���� ��1��ú�����������в������к�����H2S��Na2CO3��Һ���գ�����������ʽ��Ϊ�������ƺ�̼���⣬ԭ���غ���ƽ��д�õ���Ӧ�Ļ�ѧ����ʽ��
��2�������Ȼ�ѧ����ʽ��˹���ɼ���õ����ɸ�˹���ɢ�+��+�١�2�õ������Ȼ�ѧ����ʽ����Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʻ�ѧƽ��������У����ݻ�ѧƽ���ƶ�ԭ���ͷ�Ӧ���������ж�ѡ�
��3���ټ���Ũ���̺�ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
�ڷ�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������У�
��� �⣺��1��ú�����������в������к�����H2S��Na2CO3��Һ���գ�����������ʽ��Ϊ�������ƺ�̼���⣬ԭ���غ���ƽ��д�õ���Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+H2S�TNaHCO3+NaHS��
�ʴ𰸣�Na2CO3+H2S�TNaHCO3+NaHS��
��2����2H2��g��+CO��g��?CH3OH��g����H=-90.8kJ•mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H=-23.5kJ•mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.3kJ•mol-1
�ɸ�˹���ɢ�+��+�١�2�õ�
3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g���ġ�H=-246.4 kJ•mol-1��
һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬��Ӧ�Ƿ��ȷ�Ӧ����Ӧǰ�����������С�ķ�Ӧ��Ҫ���CO��ת���ʣ�ƽ��������У�
a��ѹ�������ѹǿ����ƽ��������У�һ����̼ת��������a���ϣ�
b������������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬ת���ʲ��䣬��b�����ϣ�
c������CO2��Ũ�ȣ�����������Ũ��ƽ��������У�һ����̼ת��������c���ϣ�
d������CO��Ũ�ȣ��������ת���ʣ�һ����̼ת���ʼ�С����d�����ϣ�
e������������ѣ�CH3OCH3����ƽ��������У�һ����̼ת��������e���ϣ�
�ʴ�Ϊ��-246.4 kJ•mol-1��a��c��e��
��3����Q=$\frac{[C{H}_{3}OC{H}_{3}][{H}_{2}O]}{[C{H}_{3}OH]^{2}}$=$\frac{0.6��0.6}{0��{4}^{2}}$=2.25��400��ƽ��������У�v��������v���棩���ʴ�Ϊ������
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H=-23.5kJ•mol-1����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������У�ƽ�ⳣ��K��С���ʴ�Ϊ����С��
���� ���⿼�����Ȼ�ѧ����ʽ����д������˹���ɵļ��㡢ƽ�ⳣ���ļ���Ӧ�ã���ѧƽ���Ӱ�����ط����жϣ�ע��ƽ�ⳣ�����¶ȱ仯����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�0.25 molO2��5.6 LH2O | |
| B�� | 0.2 mol CO2��4.48 L CO | |
| C�� | 11.2 LHCl�ͱ�״����0.5molH2 | |
| D�� | 9 gˮ�ͱ�״����11.2 L NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ�������� | B�� | C6H5OH��C6H5CH2OH | ||
| C�� | �����볬���� | D�� | �������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
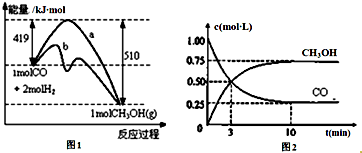 ��ҵ����CO����ȼ�ϼ״���һ���¶Ⱥ��ݻ������·�����Ӧ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾ��Ӧ�е������仯��ͼ2��ʾһ���¶��£������Ϊ1L���ܱ������м���2molH2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯����ش��������⣺
��ҵ����CO����ȼ�ϼ״���һ���¶Ⱥ��ݻ������·�����Ӧ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾ��Ӧ�е������仯��ͼ2��ʾһ���¶��£������Ϊ1L���ܱ������м���2molH2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢޢ� | B�� | �ڢۢޢ� | C�� | �ڢۢܢ� | D�� | �ڢۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
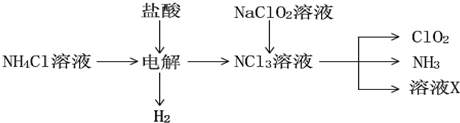
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com