
【题目】用化学用语作答
(1)书写电子式:H2____________N2_________CH4_________NaOH_________
(2)用电子式表示物质的形成过程
MgCl2_______________________________________
H2O_______________________________________
(3)两种含10电子的粒子反应生成两种10电子的粒子的离子方程式______________________
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[pOH=-lgc(OH-)]的变化关系如右图所示。下列说法正确的是
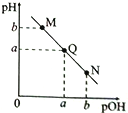
A. M点:(pH+pOH) >2a
B. N点溶液加水稀释, 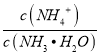 增大
增大
C. M、N两点的溶液中:[cM(NH4+)-cN(C1-)] <[cM(Cl-)-cN(NH4+)]
D. 线段MN上各点所示溶液中水的电离程度最大的不是Q点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 填空:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_________。
(2)元素周期表中位于第8纵行的铁元素属于_________族。
(3)元素周期表中最活泼的非金属元素位于第_________纵行。
(4)所含元素超过18种的周期是第_________周期。
II. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
(1)元素x在周期表中的位置是第________周期、第________族。
(2)四种元素最高价氧化物的水化物中,酸性最强的是_____,碱性最强的是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.胶体能产生丁达尔效应
C.胶体分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁及其化合物在合金材料以及催化剂等方面应用广泛。
(1)Fe3+的电子排布式为___________________。已知,Fe3+的化学性质比Fe2+稳定,请从原子结构的角度进行解释_____________________________________________________。
(2)Fe能与CO形成配合物Fe(CO)5,1 mol Fe(CO)5中含有________ mol σ键
(3)与CO互为等电子体的分子和离子分别为_______和_______(各举一种即可,填化学式)
(4)已知某铁晶体的晶胞结构如图所示。
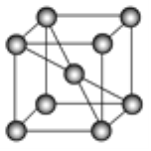
①该晶胞中含有铁原子的数目为___________。
②若晶胞的边长为a cm,则晶体铁的密度为_______________________g·cm-3(用代数式表示,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1.00mol·L-1 的 Na2CO3溶液,反应过程中加入的 Na2CO3 溶液的体积与产生沉淀或气体的质量关系如图所示。
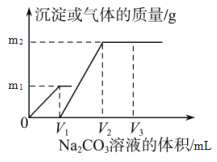
已知:图中 V1: V2=1:2,当加入 V2mLNa2CO3 溶液时,所得溶液的浓度为 1.00 mol·L-1,体积为 200mL。求:
(1)混合溶液中 CaCl2和 HCl 物质的量之比n(CaCl2)∶n(HCl)=_______。
(2)m2=______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)碳的一种同位素原子核内有8个中子,则该原子的符号为________,其质量数为______。
(2)用电子式表示CaCl2的形成过程______________________________和H2S的形成过程______________________________。
(3)A-、B2-、C+、D2+四种离子的电子数均为10。其原子半径由大到小的顺序为____________(填元素符号),其离子半径由大到小的顺序为____________(填离子符号)
(4)10g D2O的物质的量为_______,它与_______gCH4所含电子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国研制出“可充电钠——二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时每消耗3mo1C02,转移12mol电子
C. 充电时碳纳米管接直流电源的正极
D. 充电时阳极反应为C+2Na2CO3-4e-=4Na++3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com