
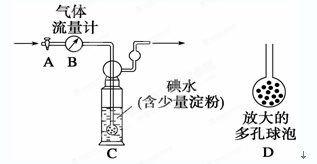
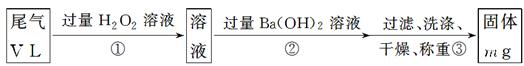
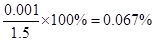


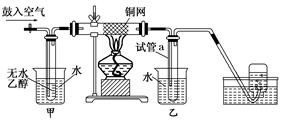
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
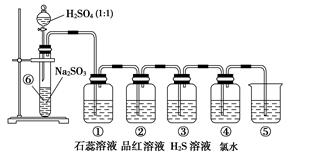
| 装置 | 实验现象 | 体现SO2的性质 |
| ① | | |
| ② | | |
| ③ | | |
| ④ | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸稀释后,没有冷却直接转移到容量瓶中 | B.定容时俯视刻度线 |
| C.转移过程中没有洗涤小烧杯 | D.容量瓶洗净后,没有干燥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
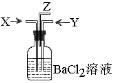
| A.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y |
| B.碳跟浓硫酸共热产生的气体X和铜跟稀硝酸反应产生的气体Y |
| C.MnO2跟浓盐酸共热产生的气体X和碳跟浓硫酸共热产生的气体Y |
| D.碳跟浓硫酸共热产生的气体X和NH4Cl与Ca(OH)2共热产生的气体Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液蒸干 |
| D.称量时,称量物放在称量纸上,置于天平左盘,砝码放在天平右盘中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
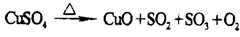
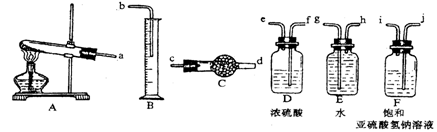
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
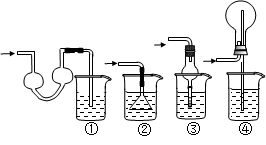
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
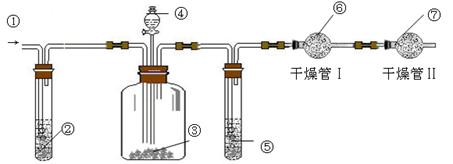
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com