
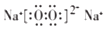 (用电子式表示).
(用电子式表示).分析 X、Y、Z、W是原子序数依次增大的短周期主族元素,Y为同周期主族元素中原子半径最大的元素,则Y为Na元素;通常状况下,X与W元素均能形成-1价的气态氢化物,则X、W位于ⅤⅡA族,X为F、W为Cl元素;X、Z和W的原子最外层电子教之和为20,则Z的最外层电子数为:20-7-7=6,Z的原子序数大于Na,则Z为S元素,据此进行解答.
解答 解:X、Y、Z、W是原子序数依次增大的短周期主族元素,Y为同周期主族元素中原子半径最大的元素,则Y为Na元素;通常状况下,X与W元素均能形成-1价的气态氢化物,则X、W位于ⅤⅡA族,X为F、W为Cl元素;X、Z和W的原子最外层电子教之和为20,则Z的最外层电子数为:20-7-7=6,Z的原子序数大于Na,则Z为S元素,
(1)X为F元素,原子序数为9,位于周期表中第二周期、第ⅦA族,
故答案为:第二周期、第ⅦA族;
(2)X、Y的离子分别为F-、Na+,两种离子的电子层数相同,氟离子的核电荷数较小,则F-的离子半径较大;
非金属性越强,对应氢化物的稳定性越强,则S和Cl元素气态氢化物的稳定性较强的是HCl,
故答案为:F-;HCl;
(3)Y为Na元素,其氧化物为氧化钠和过氧化钠,氧化钠只含有离子键,过氧化钠中含有离子键和共价键,过氧化钠的电子式为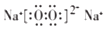 ,
,
故答案为: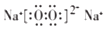 ;
;
(4)Z的最高价氧化物对应水化物的浓溶液为浓硫酸,过量浓硫酸(过量)和氧化亚铜共热,二儿子反应生成硫酸铜、二氧化硫气体和水,反应的化学方程式为:3H2SO4(浓)+Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SO2↑+3H2O,
故答案为:3H2SO4(浓)+Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+SO2↑+3H2O.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
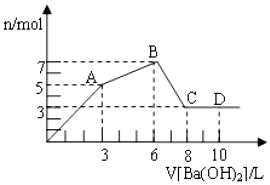 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )| A. | 图中A点生成的沉淀是BaSO4和Al(OH)3 | |
| B. | 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | AB段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO42-═BaSO4↓+2AlO2-+4H2O | |
| D. | 向D点溶液中通入CO2气体,立即产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则下列说法正确的是( )
,则下列说法正确的是( )| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和④ | |
| C. | 发生水解反应时,被破坏的键是① | |
| D. | 发生消去反应时,被破坏的键是②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌、哮喘等疾病的发生密切相关,是造成雾霾天气的主要原因 | |
| B. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘经历的步骤有:灼烧→浸泡→过滤→萃取→粗碘提纯 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2+2NaOH═Na2SiO3+H2O | B. | H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O | ||
| C. | Na2SiO3+CO2+H2O═H2SiO3+Na2CO3 | D. | SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.
,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com