
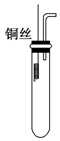
 铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.
铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同.分析 (1)补充实验的目的是装置内充满二氧化碳气体,防止生成的NO被氧化,则制取气体的实验步骤为:查、装(先固体后液体)、反应后将导管插入试管内接近液面,然后将Cu丝插入到溶液中发生反应,最后利用NO与氧气的反应确定NO的生成;
(2)推入氧气或空气的目的为检验生成的NO气体;
(3)等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,是错误的,是因生成Cu2+的浓度相同,以此来解答.
解答 解:(1)补充实验的目的是装置内充满二氧化碳气体,防止生成的NO被氧化,则制取气体的实验步骤为:①检查装置的气密性;②向试管中加入一定量的碳酸钙固体;③向试管中倒入过量稀硝酸并迅速盖上带铜丝和导管的橡皮塞;④待反应完全后,将导管插入试管内接近液面;⑤将铜丝插入到溶液中;⑥用注射器向试管内推入氧气(或空气),
故答案为:向试管中加入一定量的CaCO3固体;向试管中倒入过量的稀HNO3,并迅速盖上带铜丝和导管的橡皮塞;待反应完全后,将右边导管插入试管内接近液面;将铜丝插入到溶液中;
(2)推入氧气或空气的目的为检验生成的NO气体,故答案为:检验生成的NO气体;
(3)等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,是错误的,是因生成Cu2+的浓度相同,
溶液呈“绿色”是Cu2+与NO2混合的结果可由加热绿色溶液,有红棕色气体产生,溶液变成蓝色来说明,
故答案为:不同意;铜片的质量相同,溶液体积相同,生成Cu2+的浓度相同;加热绿色溶液,有红棕色气体产生,溶液变成蓝色.
点评 本题考查实验方案的设计,明确实验步骤及物质的性质是解答本题的关键,注意(3)中由守恒可知铜离子浓度相同是解答的易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
 |  |  | 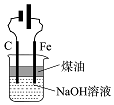 |
| A.蒸发氯化铝溶液的AlCl3 | B.分离乙酸钠和乙醇的混合液 | C.检查装置的气密性 | D.制备Fe(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业电解精炼铜时,粗铜与外电源的正极相连 | |
| B. | 常温下向纯水中加入盐酸,水的离子积减小 | |
| C. | 催化剂既能改变化学反应速率,也能改变焓变 | |
| D. | 其它条件不变时,升髙温度,吸热反应的v(正)增大,v(逆)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )
脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )| A. | 能发生加成反应 | B. | 属于芳香族化合物 | ||
| C. | 分子式为C13H16N2O2 | D. | 不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | CuCl2 | C. | NaOH | D. | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
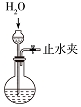
| A. | 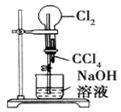 打开止水夹,挤压装置如图的胶头滴管使CCl4全部进入烧瓶 | |
| B. | 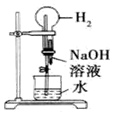 打开止水夹,挤压如图装置的胶头滴管使NaOH溶液全部进入烧瓶 | |
| C. | 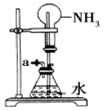 打开止水夹,用鼓气装置从如图装置的a处不断鼓入空气 | |
| D. |  打开止水夹,向如图装置的水槽中慢慢加入足量浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 | |
| B. | 有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| C. | 有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 | |
| D. | 有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
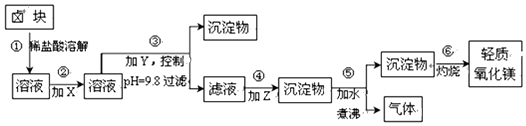
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO) | 800 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com