
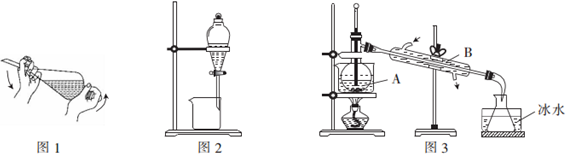
分析 (1)分液漏斗在使用前必须检验是否漏水,苯的密度比水小;
(2)可用分液的方法分离两层液体;
(3)水浴加热,稳定恒定,易控制,图3中仪器A蒸馏烧瓶,温度计用于测量馏分的温度,且苯易燃烧;
(4)苯易挥发,可用冰水冷却.
解答 解:(1)分液漏斗在使用前必须检验是否漏水,苯的密度比水小,则苯在上层,故答案为:检查是否漏水;上层;
(2)可用分液的方法分离两层液体,故答案为:分液;
(3)苯的沸点低于100℃,水浴加热,稳定恒定,易控制,图3中仪器A蒸馏烧瓶,冷水的进入方向错误,且温度计用于测量馏分的温度,应在支管口附近,且苯易燃烧,明火加热易着火,
故答案为:苯的沸点低于100℃,水浴加热受热均匀且易控制温度;蒸馏烧瓶;温度计插入位置不对;苯易燃烧,明火加热,易着火;
(4)苯易挥发,可用冰水冷却,易避免防止污染空气,故答案为:减少苯的挥发,防止污染空气.
点评 本题考查物质的分离、提纯,为高频考点,侧重考查学生的分析、实验能力,注意把握物质的性质以及实验仪器的使用,把握操作方法,难度不大.


 口算题卡北京妇女儿童出版社系列答案
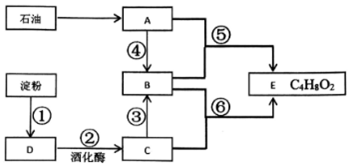
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
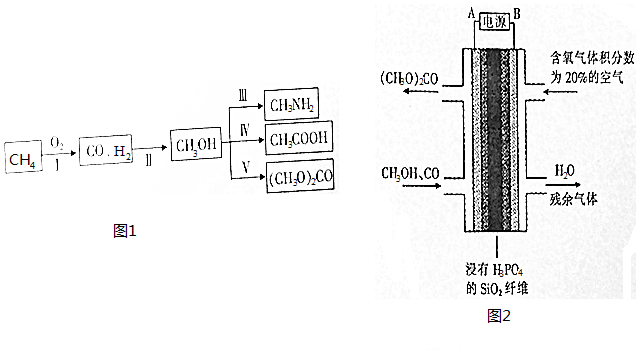
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若C溶于水后得到强碱溶液,则A可能是Na | |
| B. | 若向C溶液中逐滴加入NaOH溶液,溶液中出现白色沉淀并逐渐消失,则A可能Al | |
| C. | 若C的溶液遇NaHCO3固体,放出CO2气体,则A可能是H2 | |
| D. | 若C的溶液中滴加NaOH产生白色沉淀,后白色沉淀消失,则B可能为Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
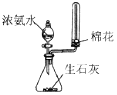 | 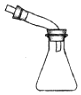 | 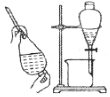 | 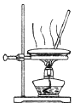 |
| 快速制备和收集一定量的氨气 | 蒸馏时的接收装置 | 用于分离C2H5OH和水混合物 | 直接蒸发氯化铁溶液获得氯化铁晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
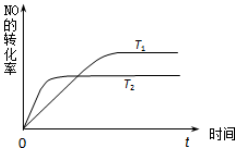 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com