
分析 X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质,地壳中含量最高的非金属元素为氧元素,与X同主族、与Y同周期,则X为S元素、Y为N元素,Z是地壳中含量最高的金属元素,则Z为Al.
(1)实验室利用亚硫酸钠与硫酸反应或利用Cu与浓硫酸反应等制备二氧化硫;
(2)0.1mol•L-1的NaHSO3溶液pH=6,说明HSO3-的电离程度大于其水解程度,故c(Na+)>c(HSO3-),而溶液中水也电离得到H+,故c(H+)>c(SO32-);
(3)氧化铝与氢氧化钠反应反应得到偏铝酸钠与水;
(4)化学平衡常数为平衡时,生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值;
(5)NH3与氧气反应产生两种无污染物质,反应方程式为:4NH3+3O2=2N2+6H2O,
已知:①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1;
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,
根据盖斯定律,①-②×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g);
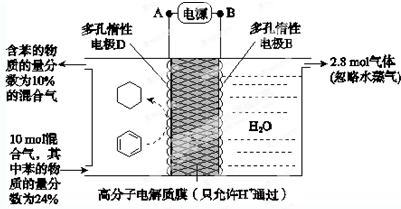
(6)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向正极;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
③阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,结合反应前后苯的物质的量分数计算参加反应苯的物质的量,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
解答 解:X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质,地壳中含量最高的非金属元素为氧元素,与X同主族、与Y同周期,则X为S元素、Y为N元素,Z是地壳中含量最高的金属元素,则Z为Al.
(1)实验室利用亚硫酸钠与硫酸反应或利用Cu与浓硫酸反应等制备二氧化硫,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,或2H2SO4(浓)+Cu $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或2H2SO4(浓)+Cu $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)0.1mol•L-1的NaHSO3溶液pH=6,说明HSO3-的电离程度大于其水解程度,故c(Na+)>c(HSO3-),而溶液中水也电离得到H+,故c(H+)>c(SO32-),溶液中氢氧根离子浓度远小于SO32-,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)氧化铝与氢氧化钠反应反应得到偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)反应NO(g)+NO2(g)?N2O3(g)的平衡常数k=$\frac{c({N}_{2}{O}_{3})}{c(NO)•c(N{O}_{2})}$,故答案为:$\frac{c({N}_{2}{O}_{3})}{c(NO)•c(N{O}_{2})}$;
(5)已知:①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1;
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,
根据盖斯定律,①-②×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1265.8kJ•mol-1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1265.8kJ•mol-1;
(6)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极,所以电子从A流向D,故答案为:A→D;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C6H6+6H++6e-=C6H12;
③阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气,转移电子的物质的量=2.8mol×4=11.2mol,生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量$\frac{10mol×24%-x}{10mol-3xmol+5.6mol}$×100%=10%,x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则 $\frac{7.2mol}{11.2mol}$×100%=64.3%,故答案为:64.3%.
点评 本题以元素推断为载体,可知气体制备、离子浓度大小比较、平衡常数、热化学方程式书写、电化学原理、化学计算等,(6)中计算为易错点、难点,侧重学生分析应用能力的考查,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | CuCl2+2NaOH═Cu(OH)2↓+2NaCl | B. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu | ||
| C. | Mg+2HCl═MgCl2+H2↑ | D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应 | |
| B. | NaHCO3俗称小苏打,Na2CO3俗称苏打或纯碱 | |
| C. | Na2CO3很稳定,而NaHCO3受热时容易分解 | |
| D. | 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .合成N、F的路线如下:
.合成N、F的路线如下: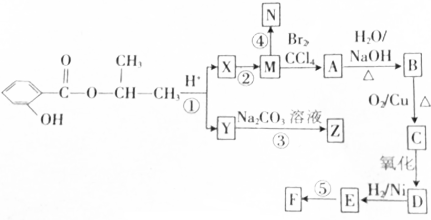
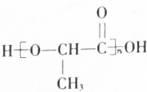
 ,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇.
,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇. →
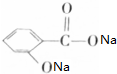
→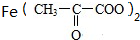 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中KOH的物质的量浓度不变 | |
| C. | 该燃料电池的总反应方程式为O2+2H2═2H2O | |
| D. | 用该燃料电池CuCl2溶液,产生2.24LCl2(标况)时,有0.2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
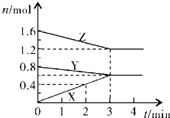 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L CO2与8.5g NH3所含分子数相等 | |
| B. | 等质量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| D. | 同温同压下,相同质量的NO和C2H4(气体)体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂都是KMnO4 | |
| B. | 该反应的还原产物只有MnO2 | |
| C. | 该反应的氧化产物是O2 | |
| D. | KMnO4中Mn元素表现氧化性,O元素表现还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com