
ÄʵĻÆŗĻĪļŌŚÉś²śŗĶÉś»īÖŠĘšµ½ÖŲŅŖµÄ×÷ÓĆ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Ģ¼ĖįĒāÄĘĖ×³Ę £¬Ė®ČÜŅŗ³Ź ŠŌ”£Ģ¼ĖįĒāÄĘ·ŪÄ©æÉÓĆÓŚÖĪĮĘĪøĖį£Ø0.2%-0.4% µÄŃĪĖį£©¹ż¶ą£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ £»
£Ø2£©³żČ„NaHCO3ČÜŅŗÖŠÉŁĮæµÄNa2CO3ČÜŅŗ£¬ £ØĢī”°ÄÜ”±»ņ”°²»ÄÜ”±£©ÓĆ×ćĮæµÄ³ĪĒå ŹÆ»ŅĖ®£¬ŌŅņŹĒ £ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£» µČÖŹĮæµÄĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄĘ·Ö±šÓė×ćĮæĻ”ŃĪĖį·“Ó¦²śÉśĘųĢåµÄĪļÖŹµÄĮæÖ®±Č £»
£Ø3£©¹żŃõ»ÆÄĘæÉÓĆÓŚŗōĪüĆę¾ß»ņĒ±Ė®Ķ§ÖŠŃõĘųµÄĄ“Ō“£¬Š“³ö»Æѧ·“Ó¦·½³ĢŹ½£¬²¢ÓĆĖ«ĻßĒŷرź Ć÷µē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ £»ČōÓŠ 5.6LĖ®ÕōĘųĶعżŅ»¶ØÖŹĮæµÄ¹żŃõ»ÆÄĘ·ŪÄ©ŗó£¬ĘųĢåĢå»ż¼õŠ”µ½4.48 L£¬ŌņĘųĢåµÄ³É·ÖŹĒ £¬ĘųĢåµÄ×ÜÖŹĮæŹĒ ”££ØĘųĢåĢå»żŅŃÕŪĖć³É±ź×¼×“æö£©

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
| ||
| ³äµē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā

| ³ĮµķĪļ | Fe£ØOH£©3 | Fe£ØOH£©2 | Al£ØOH£©3 |
| æŖŹ¼³Įµķ | 2.3 | 7.5 | 3.4 |
| ĶźČ«³Įµķ | 3.2 | 9.7 | 4.4 |
 [Fe2£ØOH£©4]2++2H+
[Fe2£ØOH£©4]2++2H+ [Fe2£ØOH£©4]2++2H+
[Fe2£ØOH£©4]2++2H+
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012½ģÖŲĒģŹŠøßČżæ¼Ē°Ä£Äā²āŹŌĄķæĘ×ŪŗĻŹŌĢā»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
£Ø15·Ö£©ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĢśŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ ”£
£Ø2£©Š“³öFeÓėĻ”ĮņĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
£Ø3£©ŅŃÖŖ£ŗFe2O3£Øs£©+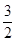 C£Øs£©=
C£Øs£©=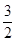 CO2£Øg£©+2Fe£Øs£©£»”÷H=+234.1kJ/mol
CO2£Øg£©+2Fe£Øs£©£»”÷H=+234.1kJ/mol
C£Øs£©+O2£Øg£©=CO2£Øg£©; ”÷H=-393.5kJ/mol£®
ĒėŠ“³öFe£Øs£©ÓėO2£Øg£©·“Ӧɜ³ÉFe2O3£Øs£©µÄČČ»Æѧ·½³ĢŹ½ ”£
£Ø4£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ńõ»ÆĢśæÉŅŌÓėŅ»Ńõ»ÆĢ¼·¢ÉśĻĀĮŠ·“Ó¦£ŗ
Fe2O3£Øs£©+3CO£Øg£©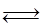 2Fe£Øs£©+3CO2£Øg£©;¹¤ŅµÉĻÓŠ16 t Fe2O3ŌŚ200m3µÄČŻĘ÷ÖŠ·“Ó¦£¬lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņÕā¶ĪŹ±¼äÄŚCOµÄĻūŗÄĖŁĀŹĪŖ mol/£ØL”¤h£©£®
2Fe£Øs£©+3CO2£Øg£©;¹¤ŅµÉĻÓŠ16 t Fe2O3ŌŚ200m3µÄČŻĘ÷ÖŠ·“Ó¦£¬lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņÕā¶ĪŹ±¼äÄŚCOµÄĻūŗÄĖŁĀŹĪŖ mol/£ØL”¤h£©£®
£Ø5£©°®µĻÉśŠīµē³ŲµÄ·“Ó¦Ź½ĪŖ£ŗFe+NiO2+2H2O Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįÄĘ£Ø Na2FeO4£©ŹĒŅ»ÖÖŠĀŠĶŅūĖ®Ļū¶¾¼Į£®ÓĆĢā29Ķ¼×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįÄĘ£Ø Na2FeO4£©ŹĒŅ»ÖÖŠĀŠĶŅūĖ®Ļū¶¾¼Į£®ÓĆĢā29Ķ¼×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
¢Ł“Ė×°ÖĆÖŠ°®µĻÉśŠīµē³ŲµÄøŗ¼«ŹĒ____£ØĢī”°a”±»ņ"b”±£©£®
¢ŚŠ“³öŃō¼«µÄµē¼«·“Ó¦Ź½________£®
¢Ūµ±ÖʵĆ132£®8gøßĢśĖįÄĘŹ±£¬Ńō¼«Ēų¼õÉŁµÄŅõĄė×ÓµÄĪļÖŹµÄĮæĪŖ £®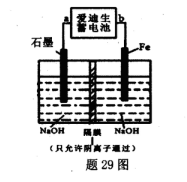
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012ѧğÖŲĒģŹŠøßČżæ¼Ē°Ä£Äā²āŹŌĄķæĘ×ŪŗĻŹŌĢā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø15·Ö£©ĢśŗĶĢśµÄ»ÆŗĻĪļŌŚ¹¤ŅµÉś²śŗĶČÕ³£Éś»īÖŠ¶¼ÓŠ¹ć·ŗµÄÓĆĶ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĢśŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ ”£
£Ø2£©Š“³öFeÓėĻ”ĮņĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
£Ø3£©ŅŃÖŖ£ŗFe2O3£Øs£©+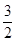 C£Øs£©=
C£Øs£©=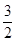 CO2£Øg£©+2Fe£Øs£©£»”÷H=+234.1kJ/mol
CO2£Øg£©+2Fe£Øs£©£»”÷H=+234.1kJ/mol
C£Øs£©+O2£Øg£©=CO2£Øg£©; ”÷H=-393.5kJ/mol£®
ĒėŠ“³öFe£Øs£©ÓėO2£Øg£©·“Ӧɜ³ÉFe2O3£Øs£©µÄČČ»Æѧ·½³ĢŹ½ ”£
£Ø4£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ńõ»ÆĢśæÉŅŌÓėŅ»Ńõ»ÆĢ¼·¢ÉśĻĀĮŠ·“Ó¦£ŗ
Fe2O3£Øs£©+3CO£Øg£©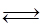 2Fe£Øs£©+3CO2£Øg£©;¹¤ŅµÉĻÓŠ16 t Fe2O3ŌŚ200m3µÄČŻĘ÷ÖŠ·“Ó¦£¬lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņÕā¶ĪŹ±¼äÄŚCOµÄĻūŗÄĖŁĀŹĪŖ mol/£ØL”¤h£©£®
2Fe£Øs£©+3CO2£Øg£©;¹¤ŅµÉĻÓŠ16 t Fe2O3ŌŚ200m3µÄČŻĘ÷ÖŠ·“Ó¦£¬lŠ”Ź±ŗó²āµĆFe2O3µÄ×Ŗ»ÆĀŹĪŖ50%£¬ŌņÕā¶ĪŹ±¼äÄŚCOµÄĻūŗÄĖŁĀŹĪŖ mol/£ØL”¤h£©£®
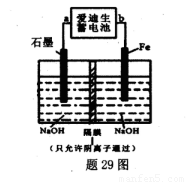
£Ø5£©°®µĻÉśŠīµē³ŲµÄ·“Ó¦Ź½ĪŖ£ŗFe+NiO2+2H2O Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįÄĘ£Ø Na2FeO4£©ŹĒŅ»ÖÖŠĀŠĶŅūĖ®Ļū¶¾¼Į£®ÓĆĢā29Ķ¼×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįÄĘ£Ø Na2FeO4£©ŹĒŅ»ÖÖŠĀŠĶŅūĖ®Ļū¶¾¼Į£®ÓĆĢā29Ķ¼×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
¢Ł“Ė×°ÖĆÖŠ°®µĻÉśŠīµē³ŲµÄøŗ¼«ŹĒ____£ØĢī”°a”±»ņ"b”±£©£®
¢ŚŠ“³öŃō¼«µÄµē¼«·“Ó¦Ź½________£®
¢Ūµ±ÖʵĆ132£®8gøßĢśĖįÄĘŹ±£¬Ńō¼«Ēų¼õÉŁµÄŅõĄė×ÓµÄĪļÖŹµÄĮæĪŖ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğŗŚĮś½Ź”¹ž¶ū±õĮłÖŠøßČż£ØÉĻ£©ĘŚÖŠ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ½ā“šĢā
 Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįĖįÄĘ£ØNa2FeO4£©ŹĒŅ»ÖÖŠĀŠĶ¾»Ė®¼Į£®ÓĆĻĀĆę×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
Fe£ØOH£©2+Ni£ØOH£©2£»øßĢśĖįĖįÄĘ£ØNa2FeO4£©ŹĒŅ»ÖÖŠĀŠĶ¾»Ė®¼Į£®ÓĆĻĀĆę×°ÖĆæÉŅŌÖĘȔɣĮæøßĢśĖįÄĘ£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com