


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| PH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
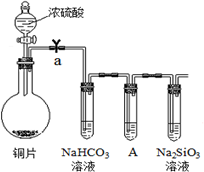 下表是元素周期表的一部分,表中所列字母分别代表一种元素.
下表是元素周期表的一部分,表中所列字母分别代表一种元素.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | A | ||||||
| 二 | B | C | D | E | |||
| 三 | F | G | H | I | K | ||
| 四 | J | L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com