
| m |
| M |
| n |
| V |
| 5.6g |
| 56g/mol |
| 0.2mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、氧化性 | B、还原性 |
| C、碱性 | D、酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某雨水样品放置一段时间,pH由5.6变为4.3,说明水中溶解了更多的CO2 |
| B、用一束强光照射经过煮沸的三氯化铁溶液有光的通路,说明已生成氢氧化铁胶体 |
| C、常温下铜可溶于浓硝酸,铁不溶于浓硝酸,说明铜比铁更活泼 |
| D、二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Ne]3s13p3 |
| B、[Ar]3d64s1 |
| C、[Ar]3d64s2 |
| D、[Ne]3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C、反应(i)的产物比反应(ii)的产物稳定 |
| D、反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,1mol水的体积是22.4L |
| B、1molH2所占的体积一定是22.4L |
| C、在标准状况下,NA个任何分子所占的体积约为22.4L |
| D、在标准状况下,28g的N2体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、在标准状况下,2.24 L CH2Cl2含有σ键的数目为0.4NA |
| C、某密闭容器盛有0.1molN2与0.3molH2,在一定条件下充分反应生成NH3,转移的电子数为0.6NA |
| D、向沸水中逐滴加入100 mL 0.1 mol/L饱和FeCl3溶液,形成的胶粒数小于0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
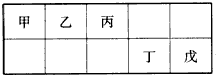
| A、最外层电子数:甲>乙>丙>丁>戊 |
| B、简单离子的离子半径:戊>丁>丙 |
| C、含有丁元素的酸有多种 |
| D、乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com