
| A、6:1 | B、1:1 |
| C、5:1 | D、1:5 |
| ||
| ||


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、电解池的阳极和原电池的负极上都发生氧化反应 |
| B、化学性质活泼的一极在原电池中一定作负极,在电解池中一定作阴极 |
| C、原电池与电解池都是将电能转化为其他能量形式的装置 |
| D、用惰性电极电解稀硫酸溶液,阴、阳极产物的质量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸与氢氧化钠溶液反应 |
| B、二氧化碳与过氧化钠反应 |
| C、氯化氢与氨气反应生成氯化铵固体 |
| D、氯化氢溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2(g)+
| ||
| B、2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2H2+O2=2H2O△H=-571.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
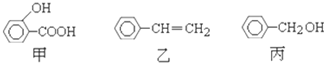
| A、甲、乙、丙都能发生加成反应、取代反应 |
| B、丙与C6H5OH都含有-OH,质谱图显示的质荷比最大值相差14,但不属于同系物 |
| C、淀粉、油脂、有机玻璃等都属于高分子化合物 |
| D、乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d |
| B、若从正反应开始,平衡时,A、B的转化率相等,则A、B的起始物质的量之比为a:b |
| C、若平衡体系中共有气体M mol,再向其中充入b mol B,达到平衡时气体总物质的量为M+b mol,则a+b>c+d |
| D、若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH |
| B、BrCH2CH2COOH |
| C、CH3CH(OH)CH3 |
| D、CH2=C(OH)COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com