
【题目】下列分子中,既含有σ键,又含有π键的是
A.CH4 B.HCl C.CH2===CH2 D.F2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是 ( )
A. 同周期元素,随着核电荷数的增加,I1总体上呈现由小到大的变化趋势
B. 电离能越大,表示气态时该原子越易失电子
C. 元素的电负性越大,表示其原子在化合物中吸引电子能力越强
D. 电负性是相对的,所以没有单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
B. 增大压强可加快SO2转化为SO3的速率
C. 黄绿色的氯水光照后颜色变浅
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )

A.图2装置中Cu电极上发生的电极反应式为:Cu-2e-==Cu2+
B.图1为原电池装置,Cu电极上产生的是O2
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电流均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌焙砂主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物。下图是工业上利用锌焙砂制取金属锌的流程图。
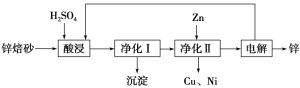
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式: _________________________________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe(OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是__________________________________。
(3)本流程中可以循环利用的物质除硫酸锌外还有__________________。
(4)若没有净化Ⅱ操作,则对锌的制备带来的影响是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们对CO2的应用研究日新月异。
(1)合成尿素的原料是CO2和NH3,合成原理分两步:
①合成氨基甲酸铵:CO2(g)+2NH3(g)===NH2COONH4(s) ΔH=-159.47 kJ/mol
②氨基甲酸铵分解:NH2COONH4(s)===CO(NH2)2(s)+H2O(l) ΔH=+28.49 kJ/mol
则2 mol CO2完全反应合成尿素所________(填“吸收”或“释放”)的热量为________。
(2)最近科学家们研制成功一种新型催化剂,能将CO2转变为甲烷。在常压,300 ℃,CO2与H2体积比为1∶4时反应,CO2转化率达90%。
①写出此反应的化学方程式:_______________________。
②某兴趣小组,在一定条件下,在体积为V L的密闭容器中,模拟发生此反应达到化学平衡状态。该反应的平衡常数表达式为__________________________;
由下图可知升高温度,K将________(填“增大”、“减小”或“不变”);300 ℃时,从反应开始到达到平衡,以H2的浓度变化表示化学反应速率:______________(用nA、tA、V表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com