
分析 KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O中双氧水中O元素化合价由-1价变为0价、Mn元素化合价由+7价变为+4价,根据转移电子相等配平方程式,得出氧化剂和被氧化的元素的物质的量之比;③K2MnF6+SbF5→KSbF6+MnF3+F2↑,K2MnF6中Mn元素的化合价降低,F元素的化合价升高,据此回答.
解答 解:反应①KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O中,双氧水中O元素化合价由-1价变为0价、O元素被氧化,Mn元素化合价由+7价变为+4价,根据转移电子相等得转移电子数为6,再结合原子守恒配平方程式为:2KMnO4+3H2O2+2KF+10HF=2K2MnF6+3O2↑+8H2O,KMnO4是氧化剂,O元素被氧化,
氧化剂和被氧化的元素的物质的量之比为2:6=1:3,③K2MnF6+SbF5→KSbF6+MnF3+F2↑中,K2MnF6中Mn元素的化合价降低,其中F元素的化合价升高,SbF5中元素的化合价都没变,所以③中SbF5表现的性质为酸性,故答案为:1:3;酸.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的计算及电子守恒的应用,题目难度不大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢是原子半径最小的元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 周期表中有7个主族、7个副族 | |
| D. | 硫元素位于第三周期VIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | 第三周期元素的离子半径从左到右逐渐减小 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增加 | |
| D. | VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
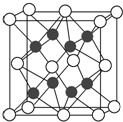 化合物Na2O的晶胞如图.
化合物Na2O的晶胞如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中, 再滴加CCl4,振荡、静置,向上层溶液中滴 加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性: Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 浓度相同的ZnCl2、CuCl2溶液中,滴入少量Na2S溶液 | 只有黑色沉淀 | Ksp(CuS)>Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁、NaOH溶液 | B. | 铜、稀硫酸 | C. | 锌、浓硝酸 | D. | 铁、FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| B. | Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | |
| C. | ${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| D. | 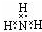 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
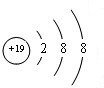
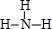 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com