
(1)由X、Y、Z三种元素组成的化合物有多种,其水溶液呈酸性的有(要求写三种,用化学式表示)________________、____________________、________________________。
(2)Y和P形成的化合物M(Y元素呈—3价)在熔融时能导电,与水反应后溶液呈碱性,并放出一种气体。
①M的电子式是_________,M属于_________晶体,Y单质的电子式是_________。
②比较粒子半径:Y阴离子_________P阳离子(填“>”“<”或“=”)
③M与水反应的化学方程式为____________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子价电子排布式为ns1,Y元素是空气中含量最多的元素,Z 与W同主族,而且W原子的电子排布式中,p轨道上只有1个未成对电子.
已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大,X元素原子价电子排布式为ns1,Y元素是空气中含量最多的元素,Z 与W同主族,而且W原子的电子排布式中,p轨道上只有1个未成对电子.

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
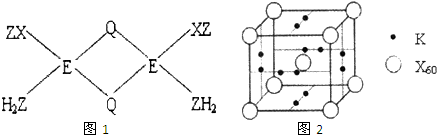 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com