
【题目】工业制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)=Si(s)+ 4HCl(g)△H=QkJmol-1(Q>0)。在一定某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应,下列叙述错误的是
A.反应过程中,若充入一定量NH3,可能提高SiCl4的转化率
B.若反应开始时加入1mol SiCl4,则达到平衡时,.吸收热量小于Q kJ
C.反应至4min时,若HCl浓度为0.12 molL-l,H2的反应速率为0.03 molL-1min-1
D.当反应吸收热量为0.025QkJ时,生成的 HC1 恰好中和 0.l molNaOH
【答案】C
【解析】
A.充入氨气后,NH3和HCl反应生成NH4Cl固体而降低c(HCl),平衡正向移动,则SiCl4的转化率提高,故A正确;
B.该反应为可逆反应,反应物不能完全转化为生成物,所以达到平衡时吸收的热量小于QkJ,故B正确;
C.4min内v(HCl)=![]() =0.03molL-1min-1,相同时间内v(H2)=
=0.03molL-1min-1,相同时间内v(H2)=![]() v(HCl)=
v(HCl)=![]() ×0.03molL-1min-1=0.015molL-1min-1,故C错误;
×0.03molL-1min-1=0.015molL-1min-1,故C错误;
D.如果吸收0.025QkJ热量则生成n(HCl)=![]() ×4mol=0.1mol,HCl和NaOH以1:1反应,所以生成的HCl能中和0.1molNaOH,故D正确;
×4mol=0.1mol,HCl和NaOH以1:1反应,所以生成的HCl能中和0.1molNaOH,故D正确;
故选:C。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】莫西沙星主要用于治疗呼吸道感染,合成路线如下:
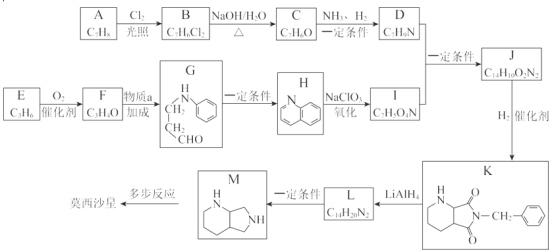
已知: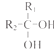
![]()
![]() +H2O
+H2O
(1)A 的结构简式是__。
(2)A→B 的反应类型是__。
(3)C 中含有的官能团是__。
(4)物质 a 的分子式为 C6H7N,其分子中有__种不同化学环境的氢原子。
(5) I 能与 NaHCO3 反应生成 CO2,D+I→J 的化学方程式是__。
(6) 芳香化合物 L 的结构简式是__。
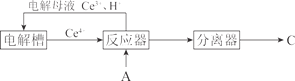
(7)还可用 A 为原料,经如下间接电化学氧化工艺流程合成 C,反应器中生成 C 的离子方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
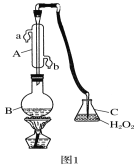
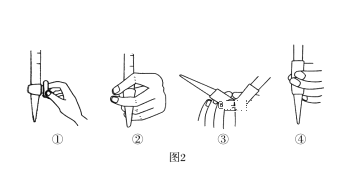
(1)仪器A的名称是_________,水通入A的进口为________。(a/b)
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为__________________。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的______ (填序号);若滴定终点时溶液的pH=8.8,则选择的指示剂为_________(酚酞/甲基橙);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积____(填序号)(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是(已知质子交换膜只允许H+通过)( )
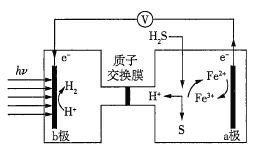
A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、铜及其化合物用途非常广泛。回答下列问题:
(1)基态Br原子核外电子排布式为[Ar]___。
(2)已知反应:Cu(BF4)2.6H2O+Cu+8CH3CN=2[Cu(CH3CN)4]BF4+6H2O。
①配合物[Cu(CH3CN)4]BF4中,与铜形成配位键的原子是___,BF4-的空间构型是___,与BF4-互为等电子体的分子有___(任写一种)。
②CH3CN分子中碳原子的杂化方式是___;1个CH3CN分子中含有___个σ键。
(3)电子亲合能与电离能相对应,元素的气态基态原子获得一个电子成为气态一价负离子所释放的能量称为该元素的第一电子亲合能,其大小主要取决于原子的有效核电荷、原子半径和原子的电子构型等因素。Br与F、Cl位于同一主族,第一电子亲合能(如图1所示)原比氯和溴都小,其原因是___。
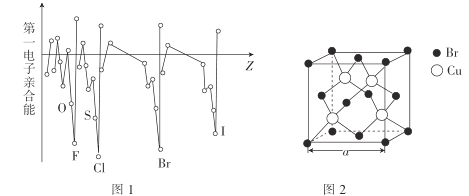
(4)溴化亚铜(晶胞结构如图2所示)可用作有机合成的催化剂,密度为4.71g·cm-3。
①晶胞中Br-的配位数为___。
②晶胞参数a=___(列出表达式即可)nm。(设NA为阿伏加德罗常数的数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液的说法中正确的是
A.pH=7的溶液中,Na+、NH4+、CH3COO-、NO3-可以大量共存
B.Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9,任何条件下二者不可能相互转化
C.1mol/LNa2SO4溶液中阴离子数目大于1mol/LNa2CO3溶液中阴离子数目
D.Na2S溶液与FeC13溶液混合后产生沉淀,该沉淀一定是Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究温度对反应2H2S(g)![]() 2H2(g) +S2(g)的影响,兴趣小组进行如下探究:向三个体积均为2L的恒容密团容器(A1、A2、A3)中分别加入等量的H2S,进行H2S分解实验。在T1、T2、T3,下测得H2的物质的量与时间的关系如下图所示:
2H2(g) +S2(g)的影响,兴趣小组进行如下探究:向三个体积均为2L的恒容密团容器(A1、A2、A3)中分别加入等量的H2S,进行H2S分解实验。在T1、T2、T3,下测得H2的物质的量与时间的关系如下图所示:
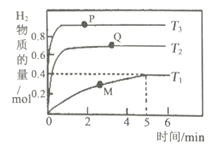
(1)该反应的△H____0(填“>”“<”或“=”,下同),T2、T3温度下的平衡常数K2______K3。
(2)T1温度下,前5min用S2(g)表示的反应速率为_____。
(3)图中P、Q、M三点逆反应速率由小到大的顺序是_____。
(4)已知v正=k正c2(H2S),v逆=k逆c2(H2)c(S2), 温度为T1时,k逆=3.4k正。则该温度下的化学平衡常数的值为___(保留小数点后两位数字)。
(5)在A容器中,下列选项中能标志反应2H2S(g)![]() 2H2(g) +S2(g)达到平衡的是___(填写序号)。
2H2(g) +S2(g)达到平衡的是___(填写序号)。
a v正(H2S)=2v逆(S2) b H2和S2的浓度之比为2;1
c 密度不再变化 d 平均相对分子质量不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是( )
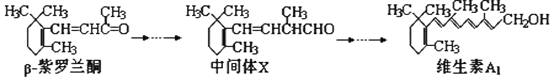
A. β—紫罗兰酮与中间体X互为同分异构体
B. β—紫罗兰酮不可使酸性KMnO4溶液褪色
C. 维生素A1易溶于NaOH溶液
D. 1mol维生素A1最多能与5molH2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com