
分析 (1)高铁酸钠(Na2FeO4)中钠为+1价,氧为-2价,依据化合物中各元素化合价代数和为0计算铁元素化合价;依据铁元素化合价判断高铁酸钠性质;
(2)Fe3+水解产生的Fe(OH)3胶体可以吸附水中悬浮物并凝聚沉降,据此写出离子方程式;
(3)根据化合物中化合价代数和为零可知,高铁酸钠中铁显+6价,有强氧化性,在净水时被还原生成铁离子,铁离子水解生成氢氧化铁胶体,氢氧化铁胶体有吸附性,能吸附水的杂质,工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,根据电子得失守恒和元素守恒可完成化学方程式;
(4)根据n=CV和m=nM来计算;根据配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、移液、洗涤、定容、摇匀来选择使用的仪器.
解答 解:(1)高铁酸钠(Na2FeO4)中钠为+1价,氧为-2价,依据化合物中各元素化合价代数和为0,可知铁元素化合价为+6价,铁处于高价态,能够降价,所以高铁酸钠具有强的氧化性;
故答案为:+6; 氧化性;
(2)Fe3+是弱碱阳离子,能结合水电离出的氢氧根生成Fe(OH)3胶体,可以吸附水中悬浮物并凝聚沉降,据此写出离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(3)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,根据电子得失守恒和元素守恒可知,反应的化学方程式为2FeCl3+10NaOH+3NaClO═2 Na2FeO4+5H2O+9 NaCl,
故答案为:Na2FeO4、H2O、NaCl;
(4)所需的NaOH的物质的量n=CV=16mol/L×0.5L=8mol,质量m=nM=8mol×40g/mol=320.0g;根据配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、移液、洗涤、定容、摇匀可知所需的仪器为天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,其中玻璃仪器有:烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为:320.0;烧杯、玻璃棒、500mL容量瓶、胶头滴管.
点评 本题考查了Na2FeO4的净水原理以及氧化还原反应的配平、溶液的配制以及电极反应的书写,明确氧化还原反应规律、盐类水解规律及应用、一定物质的量量浓度溶液的配制原理及操作步骤,题目难度中等.


科目:高中化学 来源: 题型:选择题
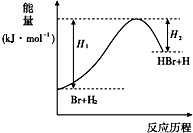
| A. | 正反应为放热反应 | |
| B. | 反应物总能量高于生成物总能量 | |
| C. | 升高温度可增大正反应速率,降低逆反应速率 | |
| D. | 加入催化剂,该化学反应的反应物的总能量与生成物的总能量差不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: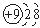 | B. | O-18的原子符号:${\;}_{10}^{18}$O | ||
| C. | NaCl的电子式: | D. | N2的结构式::N≡N: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2Z;
2Z;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1>C2 | |
| B. | 两瓶溶液的导电能力相同 | |
| C. | 第一瓶溶液的pH大于第二瓶溶液的pH | |
| D. | 第一瓶溶液中醋酸的电离程度小于第二瓶溶液中醋酸的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红色、黑色、白色 | B. | 红色、白色、白色 | C. | 红色、红色、红色 | D. | 黑色、红色、白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
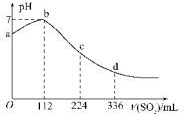 标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )| A. | 亚硫酸是比氢硫酸更弱的酸 | |
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol/L | |
| D. | b点对应的溶液导电性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com