
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:

回答下列问题:
(l) Li的原子结构示意图为____,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要____。
(6)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该反应的化学方程式为____。
【答案】 +3 2Al + 2OH- +2H2O=2AlO2-+ 3H2↑ 将LiCoO2中的Co(Ⅲ)还原为+2价 LiOH Co2++C2O42-=CoC2O4↓ 100mL容量瓶、胶头滴管 3CoC2O4+2O2
+3 2Al + 2OH- +2H2O=2AlO2-+ 3H2↑ 将LiCoO2中的Co(Ⅲ)还原为+2价 LiOH Co2++C2O42-=CoC2O4↓ 100mL容量瓶、胶头滴管 3CoC2O4+2O2![]() Co3O4+6CO2
Co3O4+6CO2
【解析】
铝钴膜主要含有LiCoO2、A1等,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液中含有偏铝酸钠,滤渣为LiCoO2,将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,然后加入氨水调节溶液的pH,生成氢氧化锂沉淀从而除去锂离子,最后对滤液用草酸铵洗涤处理,经过一系列处理得到草酸钴,据此分析解答。
(1)锂是3号元素,原子结构示意图为 ;LiCoO2中Li显+1价,氧元素显-2价,设钴元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×2=0,则x=+3;
;LiCoO2中Li显+1价,氧元素显-2价,设钴元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×2=0,则x=+3;
(2)“碱浸”时Al溶解于氢氧化钠溶液,反应的离子方程式为2Al + 2OH- +2H2O=2AlO2- + 3H2↑;
(3)“酸溶”时加入H2O2,可以将LiCoO2中的Co(Ⅲ)还原为+2价,用氨水调节pH,将锂离子转化为氢氧化锂沉淀,所得滤渣主要为LiOH;
(4)“沉钴”中CoSO4与草酸铵反应生成草酸钴,反应的离子方程式为Co2++C2O42-=CoC2O4↓;
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要经过称量、溶解、转移、洗涤、定容等步骤,需要的玻璃仪器除玻璃棒、烧杯外,还需要100mL容量瓶、胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(6)4.41 g CoC2O4的物质的量为![]() =0.03mol,其中含有钴元素的质量=0.03mol×59g/mol=1.77g,因此钴的氧化物中含有氧元素的质量=2.41g-1.77g=0.64g,氧元素的物质的量=
=0.03mol,其中含有钴元素的质量=0.03mol×59g/mol=1.77g,因此钴的氧化物中含有氧元素的质量=2.41g-1.77g=0.64g,氧元素的物质的量=![]() =0.04mol,因此该钴的氧化物为Co3O4,钴元素被氧化,因此反应物中需要氧气参与,根据元素守恒,生成物中还有二氧化碳,反应的方程式为3CoC2O4+2O2
=0.04mol,因此该钴的氧化物为Co3O4,钴元素被氧化,因此反应物中需要氧气参与,根据元素守恒,生成物中还有二氧化碳,反应的方程式为3CoC2O4+2O2![]() Co3O4+6CO2。
Co3O4+6CO2。


科目:高中化学 来源: 题型:
【题目】如图是研究铁被海水腐蚀的实验装置。图2中M是某种与铁片紧贴的金属,下列说法正确的是

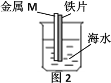
A.图1铁片靠近烧杯底部的部分,腐蚀更严重
B.若M是锌片,可保护铁
C.若M是铜片,可保护铁
D.M是铜或是锌都不能保护铁,是因没有构成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁钉放入纯水中,一段时间后,铁钉表面有铁锈生成,下列说法正确的是
![]()
A.铁钉与水面交接处最易腐蚀
B.铁钉发生吸氧腐蚀,铁做阴极
C.铁发生的反应是:Fe-3e→Fe3+
D.水上和水下部分的铁钉不发生电化腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制备HCl气体。

(1)推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥HCl气体,其原理是___(选填编号)。
a.浓硫酸吸收了盐酸中水分
b.混合时放热使HCl溶解度减小
c.浓盐酸中HCl以分子形式存在
d.浓盐酸密度小于浓硫酸
(2)为测定制备气体后残留混合酸中盐酸和硫酸的浓度,进行如下实验:取5.00mL混合酸,加水稀释至500mL,完成此操作,用到的精确定量仪器有____;称量4.7880gBa(OH)2固体,溶于水配成250mL标准溶液,装入洗净的细口试剂瓶,并贴上标签。装瓶前用标准溶液对试剂瓶进行润洗的目的是___,请你填写标签上的空白。____
![]()
(3)从500mL稀释液中取出20.00mL,滴加几滴酚酞作指示剂,用标准Ba(OH)2溶液滴定至溶液由无色变为红色才停止滴定,出现这种情况的补救措施除重做外,还有可以采取的措施是__。
(4)为完成全部测定,接下来对锥形瓶中混合物进行的操作是___、称量、___。
(5)若固体Ba(OH)2中混有少量的NaOH,会导致混合酸中硫酸浓度的测定结果___(选填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A与H2的相对密度为14,其产量可以用来衡量一个国家的石油化工发展水平。以该化合物为原料合成化合物G、E和I的流程如下:
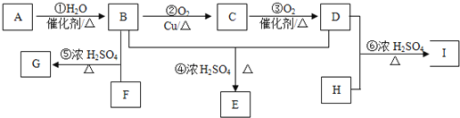
已知:Ⅰ.芳香族化合物F为C、H、O化合物,其相对分子质量为166,环上的一氯代物有一种,1molF与足量NaHCO3溶液反应能生成2molCO2,F与足量B反应生成G。
Ⅱ.H为二元醇,其蒸气密度折算成标准状况为2.77g/L,H与足量D反应生成I。
(1)A中官能团的名称为____________,E的结构简式_________________。
(2)G的分子式为_____________,反应⑤的反应类型为________________。
(3)写出下列化学方程式:②_______________________;
⑥___________________________。
(4)以乙烯为原料合成的加聚产物为![]() ,则单体是_______ 和_____。
,则单体是_______ 和_____。
(5)I有多种同分异构体,其中一类同分异构体有如下特征:
①分子中含有五元环结构;②1mol该有机物与足量NaHCO3溶液反应,能生成1 molCO2;③1mol该有机物与足量Na反应,能生成1.5 mol H2;④环上的一氯代物只有三种。则满足以上条件的有机物的所有可能的结构简式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.19g羟基(-18OH)所含中子数为10NA
B.标准状况下,44.8 L HF含有2NA个极性键
C.1 mol NaHSO4晶体含有的离子数为3NA
D.0.1 mol·L-1 KAl(SO4)2溶液中SO42-的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O> ___。基态K+电子占据最高能级的电子云轮廓图为____形。
(2) NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是____,中心原子的杂化形式为____。NaBH4中存在____(填标号)。
a. 离子键 b. 氢键 c. σ键 d. π键
(3) BeC12中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为 ___,其中Be的配位数为_____。
(4)第三周期元素氟化物的熔点如下表:
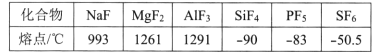
解释表中氟化物熔点变化的原因:____。
(5) CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是____。若r(F-)=x pm,r(Ca2+) =y pm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_____ g.cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为镁元素和硫元素的相关信息,由此不能得到的信息是( )

A.镁属于金属元素,在第三周期ⅡA族
B.镁原子核内有12个质子
C.镁离子与硫离子的电子层数相等
D.在化学反应中,1个硫原子容易得到2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
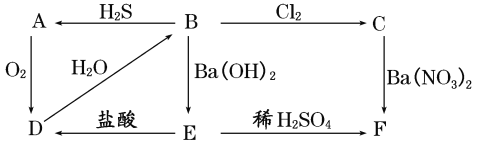
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com