
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
【答案】)第3周期、第ⅥA族 Al>C>N ![]() N2O5 2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑
N2O5 2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑
【解析】
图中所示是短周期元素Q、R、T、W在元素周期表中的位置,因为T所处的周期序数与主族族序数相等,所以可以知道T是Al,Q是C,R是N,W是S,据此解答各小题即可。
T所处的周期序数与主族族序数相等,则T为Al,结合位置可知:Q是C,R是N,W是S,
(1)W为S,S有3个电子层,最外层6个电子,故处于第三周期ⅥA族,电子层数越多,半径越大,同一周期原子序数越小,半径越大,故C、N、Al三种元素原子的半径从大到小排列顺序Al>C>N,C的最高价氧化物为二氧化碳,CO2中C与O形成两对共价键,故电子式为![]() ,R为N,N最外层有5个电子,最高价氧化物的化学式为N2O5,故答案为:第三周期ⅥA族;Al>C>N;
,R为N,N最外层有5个电子,最高价氧化物的化学式为N2O5,故答案为:第三周期ⅥA族;Al>C>N;![]() ;N2O5;
;N2O5;
(2)T为Al,与氢氧化钠反应的离子方程式为:2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑,故答案为:2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑。


科目:高中化学 来源: 题型:
【题目】现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
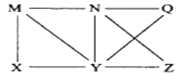
A. N一定是HCl(aq) B. X可能为Al或C12
C. Y一定为NaOH(aq) D. Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
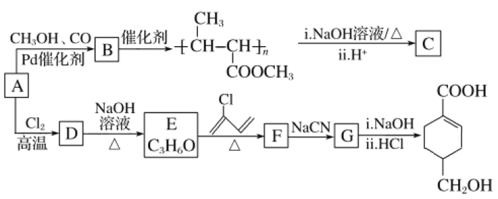
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。
已知:![]() +‖
+‖![]()
![]() ;R—C≡N
;R—C≡N![]() R—COOH
R—COOH
回答下列问题:
(1)A的名称是______________,B含有的官能团的名称是________________(写名称)。
(2)C的结构简式为________________,D→E的反应类型为_____________。
(3)E→F的化学方程式为_____________________________________________________。
(4)![]() 中最多有________个原子共平面。
中最多有________个原子共平面。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6∶1∶1的是_____________________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选) ______。合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q;x、y、z是由这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01mol·L-lw溶液中,![]() =1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
=1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
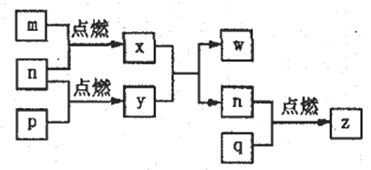
A. 原子半径的大小:a<b<c<d
B. 简单氢化物的沸点:b>d
C. y的电子式:![]()
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是
( )。
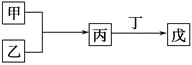
A. 若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸
B. 若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸
C. 若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2
D. 若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系。下列判断不正确的是( )
A. 若反应过程中消耗1 mol氯气,则1 mol<转移电子数<![]() mol
mol
B. 反应停止后n(NaClO)∶n(NaCl)∶n(NaClO3)(物质的量之比)可能为1∶11∶2
C. 反应过程中消耗氯气与NaOH的物质的量之比为1∶2
D. 氧化产物为NaClO和NaClO3,反应过程中n(NaClO)∶n(NaClO3)为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
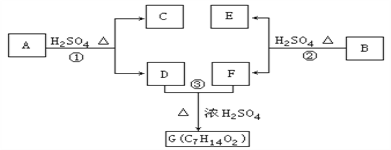
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为__________________;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为_____________,D具有的官能团是________________;
(3)反应①的化学方程式是_____________________________;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是______________________________;
(5)E可能的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物。合成其的两种中间体及羟甲香豆素的结构如下:
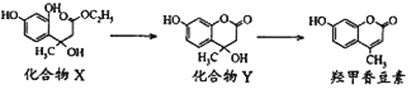
下列有关说法正确的是
A. 化合物X和Y分子各含有2个手性碳原子
B. 化合物Y能发生加成反应、取代反应和消去反应
C. lmol 羟甲香豆素最多可与2moINaOH反应
D. 化合物X和羟甲香豆素分别与溴水反应,最多消耗的Br2的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3 和 AlCl3的混合溶液中逐滴加入1 mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
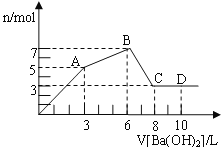
A.图中A点生成的沉淀是BaSO4和Al(OH)3
B.原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
C.AB段反应的离子方程式为:3Ba3++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
D.向D点溶液中通入CO2气体,立即产生白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com