
【题目】下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨,s)=C(金刚石,s) ΔH= +1.9kJ/mol,可知石墨比金刚石稳定
D.已知H2(g)+Cl2(g)=2HCl(g) ΔH1= -184.6kJ/mol,则反应HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g)的ΔH= -92.3kJ/mol
Cl2(g)的ΔH= -92.3kJ/mol
科目:高中化学 来源: 题型:
【题目】古埃及人在公元前一千多年前曾用橄榄石(硅酸盐)作饰品,称它为“太阳的宝石”。某小组以某橄榄石(主要成分可看作为MgO、FeO和SiO2,还含有少量的MnO等)为原料制备工业合成氨的活性催化剂(FeO和Fe2O3质量比为9:20的混合物)的一种流程如下:

金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Mg2+ | 7.6 | 9.4 |
Fe2+ | 6.5 | 9.9 |
Fe3+ | 1.5 | 3.3 |
Mn2+ | 8.2 | 10.6 |
回答以下问题:
(1)从绿色化学角度分析,试剂1宜选择___(填字母)。加入试剂1的目的是___(用离子方程式表示)。
a.H2O2 b.MnO2 c.HNO3 d.K2Cr2O7
(2)调节pH范围为___。
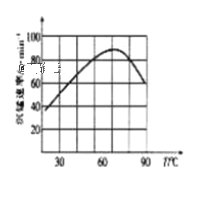
(3)单位时间内“酸浸”中金属浸出率与温度、盐酸浓度的关系如图所示。

x___(填“>”“<”或“=”)2。当盐酸浓度相同时,温度高于45℃,浸出率降低的主要原因是___。
(4)“还原”过程中,不仅要控制温度,而且要控制氧化铁和炭粉(C)的比例。若“还原”时产生气体的相对分子质量为36,理论上,480kgFe2O3需要加入___kg炭粉(C)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
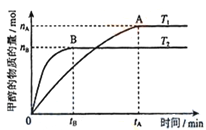
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。经2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( )
2C(g)。经2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( )
A.用物质A表示的反应速率为0.3mol·L-1·s-1
B.用物质B表示的反应速率为0.6mol·L-1·s-1
C.2s时物质A的浓度为0.7mol·L-1
D.2s时物质B的浓度为0.9mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为元素周期表中前四周期元素,且原子序数依次增大.W的基态原子中占据哑铃形原子轨道的电子数为3,![]() 与
与![]() 具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第11列.请回答:
具有相同的电子层结构;W与X的最外层电子数之和等于Y的最外层电子数;Z元素位于元素周期表的第11列.请回答:
(1)Z的基态原子M层的电子排布式为____________________.
(2)W的简单氢化物分子中W原子的__________轨道与氢原子的__________轨道重叠形成![]() 键.(填轨道名称)
键.(填轨道名称)
(3)比较Y的含氧酸的酸性:![]() __________
__________![]() (填“>”或“<”),原因为___________________.
(填“>”或“<”),原因为___________________.
(4)关于Z的化合物![]() (EDTA的结构简式如下图)的说法正确的是_____选项字母).
(EDTA的结构简式如下图)的说法正确的是_____选项字母).
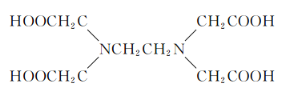
A.![]() 中所含的化学键有离子键、共价键、配位键和氢键
中所含的化学键有离子键、共价键、配位键和氢键
B.EDTA中碳原子的杂化轨道类型为![]() 、
、![]()
C.![]() 的组成元素的第一电离能顺序为
的组成元素的第一电离能顺序为![]()
D.![]() 与
与![]() 互为等电子体,空间构型均为正四面体形
互为等电子体,空间构型均为正四面体形
(5)某离子型氢化物![]() 的晶胞结构如图所示:
的晶胞结构如图所示:
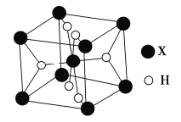
①![]() 的配位数为__________________.
的配位数为__________________.
②![]() 是一种储氢材料,遇水会缓慢反应,该反应的化学方程式为____________.
是一种储氢材料,遇水会缓慢反应,该反应的化学方程式为____________.
③若该晶胞的密度为![]() ,则晶胞的体积为______________
,则晶胞的体积为______________![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:
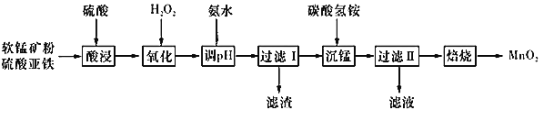
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于1×10-5mol·L-l时,可视为该金属离子已被沉淀完全。
(1)实验室预计需要使用480 mL 2 mol·L-1的硫酸,准备用18.4 mol·L-1的浓硫酸来配制,需用量筒量取浓硫酸________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_______。
(2)加入硫酸亚铁的原因为_____________________________。
(3)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_____________(用离子方程式表示)。“酸浸”时为加快反应速率可采取的措施是_____________________(至少写两个)。
(4)加入氨水应调节pH的范围为_______。“过滤II”所得滤渣为MnCO3,滤液中溶质的主要成分是_______(填化学式)
(5)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反应的离子方程式为_________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制0.2000molL﹣1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
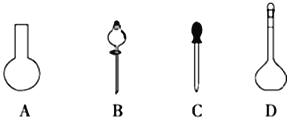
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是_________(填字母),还缺少的玻璃仪器是_________(填仪器名称)。
(2)根据计算需用天平称取Na2S2O3固体的质量是_________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_________(填“>”“<”或“=”,下同)0.2000molL﹣1.若还未等溶液冷却就定容了,则所得溶液浓度_________0.2000molL﹣1。
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000molL﹣1Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
①NaClO溶液中加入适量稀盐酸和足量KI固体时发生反应的离子方程式为_________。
②NaClO溶液的物质的量浓度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
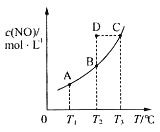
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com