
| ||


科目:高中化学 来源:不详 题型:单选题
| ||
| A.①中MnO2是氧化剂,ZnSO4是还原产物 |
| B.①中每产生16gS时转移电子的物质的量为2mol |
| C.按照②电解时,生成MnO2的电极为阴极 |
| D.该工艺流程中H2SO4可循环 |
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
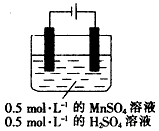
查看答案和解析>>
科目:高中化学 来源:2012年山东师大附中高考化学二模试卷(解析版) 题型:选择题
 MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
 MnO2+Zn+2H2SO4下列说法正确的是
MnO2+Zn+2H2SO4下列说法正确的是 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com