
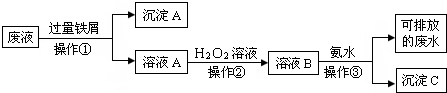
分析 Fe3+、Cu2+和过量的铁反应生成Fe2+和单质Cu,通过过滤得到固体A和溶液A,由于铁过量,沉淀A为Fe和Cu的混合物,溶液A含亚Fe2+;Fe2+具有还原性,易被氧化剂氧化,故加入H2O2能把Fe2+氧化成Fe3+,故溶液B中含Fe3+;Fe3+和氨水反应生成Fe(OH)3沉淀,故沉淀C为Fe(OH)3沉淀,废水通过处理不含Fe3+、Cu2+,可以排放.
(1)分离沉淀和溶液采取过滤的方法;
(2)操作①加入的过量的铁屑,由于铁的化学性质比铜活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在第①得到的滤渣中都含有金属铜过量的铁;
(3)根据Fe2+能被过氧化氢生成Fe3+;
(4)C是氢氧化铁,其受热易分解生成氧化铁和水;
(5)SO2和H2O2在溶液中发生氧化还原反应生成硫酸.
解答 解:Fe3+、Cu2+和过量的铁反应生成Fe2+和单质Cu,通过过滤得到固体A和溶液A,由于铁过量,沉淀A为Fe和Cu的混合物,溶液A含亚Fe2+;Fe2+具有还原性,易被氧化剂氧化,故加入H2O2能把Fe2+氧化成Fe3+,故溶液B中含Fe3+;Fe3+和氨水反应生成Fe(OH)3沉淀,故沉淀C为Fe(OH)3沉淀,废水通过处理不含Fe3+、Cu2+,可以排放.
(1)把铁铜混合物和溶液分开,采取过滤方法,故答案为:过滤;
(2)废液中含有Fe3+、Cu2+两种金属离子,加入过量的铁粉后,铁离子被还原为亚铁离子,铜离子被还原成金属铜,所以在第①得到的沉淀中含有金属铜和过量的铁,故答案为:Fe、Cu;
(3)Fe2+能被过氧化氢生成Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,观察到的实验现象是溶液由浅绿色变为黄色,
故答案为:溶液由浅绿色变为黄色;
(4)C是氢氧化铁,其受热易分解生成氧化铁和水,反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O
,故答案为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;
(5)SO2和H2O2在溶液中发生氧化还原反应生成硫酸,方程式为SO2+H2O2═H2SO4,故答案为:硫酸.
点评 本题以金属的回收和利用为载体考查物质分离和提纯,为高频考点,涉及基本操作、氧化还原反应等知识点,明确离子性质及基本操作方法是解本题关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种粒子中含有3个质子 | B. | 它的组成可用H3表示 | ||
| C. | 这种粒子中含有3个中子 | D. | 是氢的一种新的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 A→B的反应类型:加成反应
A→B的反应类型:加成反应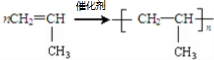 ;
;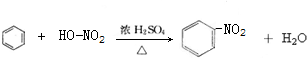 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应比金属钠与甲醇反应更剧烈 | |
| B. | 结合H+的能力CH3O-<OH- | |
| C. | 所得到溶液中K=c(CH3O-)×c(CH3OH2+) | |
| D. | 所得到溶液中c(Na+)+c(CH3OH2+)═c(CH3O-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,等浓度的H2SO4和CH3COOH溶液中的c(H+) | |
| B. | 相同温度下,等浓度的Ba(OH)2和NaOH溶液,前者与后者的c(OH-) | |
| C. | 相同温度下,0.2 mol•L-1醋酸溶液和0.1 mol•L-1醋酸溶液中的c(H+) | |
| D. | 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
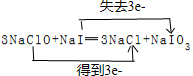 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com