
| A. | 碳酸钙受热分解 | B. | 甲烷在空气中燃烧 | ||
| C. | 镁条溶于盐酸 | D. | 过氧化钠与水反应 |
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 常温常压下,8.0g CH4中含有的价电子总数为5NA | |
| C. | 在标准状况下,22.4 L CH4与NH3混合气所含有的质子总数为10NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+具有氧化性,Fe2+具有还原性 | |
| B. | Fe3+的水溶液呈红褐色,Fe2+的水溶液呈浅绿色 | |
| C. | Fe2+的溶液中滴入强碱溶液,立即出现红褐色沉淀 | |
| D. | 铁可以在氧气中燃烧生成Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(CO):通O2,点燃 | B. | CO(CO2):通过NaOH溶液 | ||
| C. | N2(O2):通过灼热的CuO | D. | CaO(CaCO3):加水,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
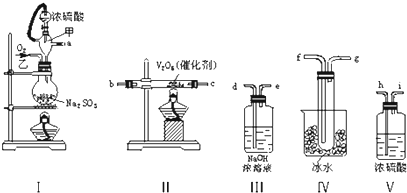
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
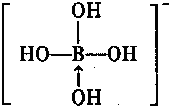 .(若存在配位键需标出)
.(若存在配位键需标出)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com