
| 实验 序号 | 温度℃ | 初始CCl4浓度 (mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |

分析 (1)实验2中110℃平衡时CCl4的平衡转化率为50%,则其浓度变化量为0.5mol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g)
起始浓度(mol/L):1 1 0 0
变化浓度(mol/L):0.5 0.5 0.5 0.5
平衡浓度(mol/L):0.5 0.5 0.5 0.5
再根据K=$\frac{c(CHC{l}_{3})×c(HCl)}{c(CC{l}_{4})×c({H}_{2})}$计算平衡常数;
(2)实验l中等效为在实验2平衡的基础上再加入0.2mol氢气,平衡正向移动,CCl4的转化率大于实验2中的转化率;
(3)实验3等效为在实验2的基础上降低温度,由于不知道反应是吸热反应,还是放热反应,不能确定降低温度平衡移动方向;
(4)氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢.
解答 解:(1)①因CCl4的沸点为77℃,CHCl3的沸点为61.2℃,所以在110℃或100℃反应时各物质均为气态,110℃时,实验2达到平衡,CCl4的转化率为50%,则其浓度变化量为0.5mol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g)
起始浓度(mol/L):1 1 0 0
变化浓度(mol/L):0.5 0.5 0.5 0.5
平衡浓度(mol/L):0.5 0.5 0.5 0.5
平衡常数K=$\frac{c(CHC{l}_{3})×c(HCl)}{c(CC{l}_{4})×c({H}_{2})}$=$\frac{0.5×0.5}{0.5×0.5}$=1,
故答案为:1;
(2)实验l中等效为在实验2平衡的基础上再加入0.2mol氢气,平衡正向移动,CCl4的转化率大于实验2中的转化率,即实验l中,CCl4的转化率>50%,故答案为:大于;
(3)实验3等效为在实验2的基础上降低温度,由于不知道反应是吸热反应,还是放热反应,不能确定降低温度平衡移动方向,所以无法判断转化率的大小,故答案为:D;
(4)由图象可知,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2起始浓度为2mol/L时,消耗CCl4的百分率变化曲线是c,故答案为:c.
点评 本题考查化学平衡计算与影响因素、化学平衡常数计算等,难度中等,注意掌握三段式计算与平衡常数的应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
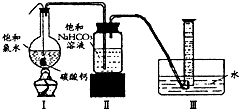 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c1:c2>1:2 | |
| B. | A和B的转化率不相等 | |
| C. | 平衡时,B和C的生成速率之比1:1 | |
| D. | c2的取值范围为0<c2<0.28 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:| 温度/℃ | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
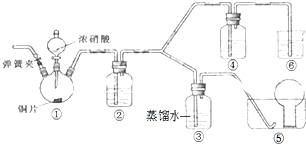 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烷烃,含有3个甲基结构的同分异构体有2种 | |
| B. | 丙烯能发生加成反应,还能使酸性KMnO4溶液褪色 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com