

分析 FeS2与氧气在高温下得到SO2、Fe2O3,A可以连续被氧化得到B,则A为SO2,B为SO3,D为Fe2O3,SO3与水反应生成C为H2SO4,I为第三主族熔点最高的金属,则I为Al,反应⑦为铝单质与氧化铁得到Fe与氧化铝,K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,F为铁盐溶液,E应为Fe(OH)3,据此解答.
解答 解:FeS2与氧气在高温下得到SO2、Fe2O3,A可以连续被氧化得到B,则A为SO2,B为SO3,D为Fe2O3,SO3与水反应生成C为H2SO4,I为第三主族熔点最高的金属,则I为Al,反应⑦为铝单质与氧化铁得到Fe与氧化铝,K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2,F为铁盐溶液,E应为Fe(OH)3.
(1)由以上分析可知,G为Fe,是26号元素,位于周期表第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
(2)反应⑦为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,氧化铁是氧化剂,铝是还原剂,氧化剂与还原剂的物质的量之比为1:2,该反应可以用于:工业冶炼铁(或焊接钢轨),
故答案为:1:2;工业冶炼铁(或焊接钢轨);
(3)在反应②、③、⑥、⑨中,②、⑨都为氧化还原反应,⑥为氢氧化铁分解得到氧化铁与水,属于分解反应,③为SO3+H2O=H2SO4,既属于化合反应又属于非氧化还原反应,
故答案为:③;
(4)M中含有Fe2+和NO3-,在酸性条件下可发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)M为Fe(NO3)2,检验含有亚铁离子方法为:取少许溶液于试管中,滴加KSCN溶液无现象,再滴加氯水显红色,则证明有Fe2+,
故答案为:取少许溶液于试管中,滴加KSCN溶液无现象,再滴加氯水显红色,则证明有Fe2+;
(6)工业上制备硝酸的第一步反应为氨气的催化氧化,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(7)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应方程式为Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
点评 本题考查无机物的推断,注意根据FeS2与氧气反应、物质的颜色等为突破口,再根据框图寻找线索进行推断,需要学生熟练掌握元素化合物性质,题目难度中等.


科目:高中化学 来源: 题型:解答题


 .
. .
. .
.

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
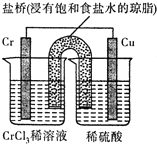 铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题:
铬(Cr)是周期表中VIB族元素,化合价可以是 0~+6 的整数价态.回答下列问题: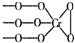 ,则Cr的化合价为+5.
,则Cr的化合价为+5.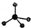 .CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为
.CrO72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个角顶氧原子彼连,结构为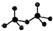 .则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.
.则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为CrnO(3n+1)2-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数 | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | pH相同的氯水和亚硝酸溶液中水电离的c(H+)相同 | |
| B. | 向氯水中滴加氢氧化钠溶液至中性:c(Na+)=2 c(ClO-)+c(HClO) | |
| C. | 向漂白粉溶液中滴加H2SO3溶液可增强其漂白能力 | |
| D. | pH相同的醋酸钠、次氯酸钠和亚硝酸钠溶液中,c(Na+)最大的是亚硝酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
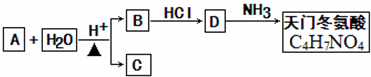
 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①只能确定溶液中有Al3+、Mg2+,没有HCO3- | |
| B. | 由②知溶液中有SO42-,没有Ba2+ | |
| C. | 由③确定溶液中有Na+,没有K+ | |
| D. | 若检验溶液中是否有存在Cl-,可取少许原溶液,直接向其中加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
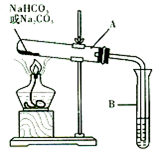 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com