
下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 向CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S的酸性比H2SO4强 |
B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C | 蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制氢氧化铜悬浊液,水浴加热,未出现红色沉淀 | 蔗糖未水解 |
D | C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源:2014-2015黑龙江省哈尔滨市高一下学期第一次月考化学试卷(解析版) 题型:选择题
主族元素在周期表中的位置取决于元素原子的
A.相对原子质量和核外电子数 B.电子层数和最外层电子数
C.相对原子质量和最外层电子数 D.电子层数和次外层电子数
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省张掖市高三第三次诊断考试理综化学试卷(解析版) 题型:填空题
(14分)、资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2(g)  CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
向一容积为 2 L的恒容密闭容器中充人一定量的CO2和H2, 在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则300℃时上述反应的平衡常数K=____________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)0。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
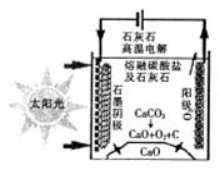
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能 b、太阳能转化为电能
c、太阳能转化为化学能 d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-,则阳极的电极反应式为__________________ _。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三十校联考理科综合化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.淀粉和纤维素均为高分子化合物,两者都是工业制造酒精的原料
B.CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷
C.等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减少
D.已知苹果酸的结构简式为 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与
,则该物质可发生氧化反应、酯化反应、缩聚反应,与 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省协作体高三下学期联考理科综合化学试卷(解析版) 题型:实验题
(15分)氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。
液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是____ (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。
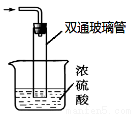
双通玻璃管的作用: ;浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省原平市高一上学期期末考试化学试卷(解析版) 题型:填空题
(10分)下图所涉及的物质均为中学化学中的常见物质,其中C为空气中能够支持燃烧的气体单质、D为黄绿色气体单质、E为日常生活中最常见的金属单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。

(1)写出有关物质的名称:B ,F 。
(2)若反应①是在加热条件下进行,则A是 (填化学式);
若反应①是在常温条件下进行,则A是 (填化学式)。
(3)写出B与MnO2共热获得D的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省原平市高一上学期期末考试化学试卷(解析版) 题型:选择题
50ml 18.4mol/L硫酸与足量的铜片加热反应,被还原的硫酸的物质的量是
A.0.92mol B.大于0.46mol, 小于0.92mol
C.0.46mol D.小于0.46mol
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省原平市高一上学期期末考试化学试卷(解析版) 题型:选择题
市场上销售的“84”消毒液,其商品标识上有如下叙述:本品为无色液体,使用时加入水稀释,可对餐具、衣物进行消毒,也可漂白浅色衣物。据此可推测其有效成分可能是
A.Cl2 B.NaClO C.KMnO4 D.Na2O2
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南四校高二上学期期末联考化学试卷(解析版) 题型:选择题
25 ℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为
A.1010∶1 B.5×109∶1 C.108∶1 D.1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com