
[s1] ���û�ѧ��Ӧԭ���о�����Ԫ�صĵ��ʼ��仯��������Ҫ���塣
��1���ϳɰ���ӦN2 (g)+3H2(g) 
 2NH3(g)����H��0�����ں��¡���ѹ��������ƽ����ϵ��ͨ���������ƽ��
�ƶ�����������ҡ���������ʹ�ô�����������Ӧ�ġ�H________������� ����С�� ���䡱����
2NH3(g)����H��0�����ں��¡���ѹ��������ƽ����ϵ��ͨ���������ƽ��
�ƶ�����������ҡ���������ʹ�ô�����������Ӧ�ġ�H________������� ����С�� ���䡱����
��2����Na2C2O4��Һ��������ʯ���Һ�� ɫ���������ӷ���ʽ��ʾ���ָ������ԭ�� ��
��3��pH��ͬ�İ�ˮ���������ƣ��ֱ�������ˮϡ����ԭ����Һ��100������ϡ�ͺ�������Һ��pH�ֱ�Ϊm��n����m n��ѡ�>����<����=������
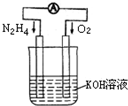
��4����������Ѱ����ʵĴ����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl�DNH4ClΪ�������Һ��������ȼ�ϵ�ء���д���õ�ص�������Ӧʽ ��
��5������ȼ����ֵ�ߡ�ʵ���ã��ڳ��³�ѹ�£�4gH2��ȫȼ������Һ̬ˮ���ų�571��6kJ���������ʾH2ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
��6��ij�¶ȣ�t�棩ʱ�����0.01mol・L��1��NaOH��Һ��pH��11���ڴ��¶��£���pH��a��H2SO4��ҺVaL��pH��b��NaOH��ҺVbL��ϣ������û��ҺΪ���ԣ���a��b��12����Va��Vb�� ��
[s1]27��
 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���û�ѧ��Ӧԭ���о��������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壮
���û�ѧ��Ӧԭ���о��������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壮| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���û�ѧ��Ӧԭ���о��������⣺
���û�ѧ��Ӧԭ���о��������⣺ 2NH3��g�������ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ��
2NH3��g�������ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� �¶� |
����̿��mol�� | NO��mol�� | E��mol�� | F��mol�� |
| ��ʼ | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
2- 3 |
- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
[s1] ���û�ѧ��Ӧԭ���о�����Ԫ�صĵ��ʼ��仯��������Ҫ���塣
��1���ϳɰ���ӦN2 (g)+3H2(g) ![]()
![]() 2NH3(g)����H��0�����ں��¡���ѹ��������ƽ����ϵ��ͨ���������ƽ�� �ƶ�����������ҡ���������ʹ�ô�����������Ӧ�ġ�H________������� ����С�� ���䡱����
2NH3(g)����H��0�����ں��¡���ѹ��������ƽ����ϵ��ͨ���������ƽ�� �ƶ�����������ҡ���������ʹ�ô�����������Ӧ�ġ�H________������� ����С�� ���䡱����
��2����Na2C2O4��Һ��������ʯ���Һ�� ɫ���������ӷ���ʽ��ʾ���ָ������ԭ�� ��
��3��pH��ͬ�İ�ˮ���������ƣ��ֱ�������ˮϡ����ԭ����Һ��100������ϡ�ͺ�������Һ��pH�ֱ�Ϊm��n����m n��ѡ�>����<����=������
��4����������Ѱ����ʵĴ����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl�DNH4ClΪ�������Һ��������ȼ�ϵ�ء���д���õ�ص�������Ӧʽ ��
��5������ȼ����ֵ�ߡ�ʵ���ã��ڳ��³�ѹ�£�4gH2��ȫȼ������Һ̬ˮ���ų�571��6kJ���������ʾH2ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
��6��ij�¶ȣ�t�棩ʱ�����0.01mol・L��1��NaOH��Һ��pH��11���ڴ��¶��£���pH��a��H2SO4��ҺVaL��pH��b��NaOH��ҺVbL��ϣ������û��ҺΪ���ԣ���a��b��12����Va��Vb�� ��
[s1]27��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com