
设C(s)+CO2(g)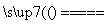 2CO(g)(ΔH=Q1 kJ·mol-1)反应速率为v1,N2(g)+3H2(g)
2CO(g)(ΔH=Q1 kJ·mol-1)反应速率为v1,N2(g)+3H2(g)
 2NH3(g)(ΔH=-Q2 kJ·mol-1)反应速率为v2,对于上述两个反应,当温度升高时,v1和v2的变化情况为( )
2NH3(g)(ΔH=-Q2 kJ·mol-1)反应速率为v2,对于上述两个反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.p区元素全部都是主族元素
B.稀有气体的原子的电子排布最外层都是以P6结束
C.主族元素的原子核外电子最后填入的能级是s能级或p能级
D.核外电子排布相同的微粒,一定具有相同的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示:

下列说法不正确的是( )。
A.氨可用作制冷剂
B.铵态氮肥一般不能与碱性化肥混合使用
C.硝酸可用于制化肥、农药、炸药、染料、盐类等
D.某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示的转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )。
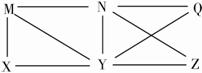
A.X可能为Al或Cl2
B.Y一定为NaOH(aq)
C.N一定是HCl(aq)
D.Q、Z中的一种必为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[H2]m[Cl2]n,式中k为常数,m、n值可用下表中数据确定。
| [H2]/mol·L-1 | [Cl2]/ mol·L-1 | v/mol·L-1·s-1 |
| 1.0 | 1.0 | 1.0 k |
| 2.0 | 1.0 | 2.0 k |
| 2.0 | 4.0 | 4.0 k |
由此可推得,m、n值正确的是( )
A.m=1、n=1 B.m=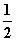 、n=
、n=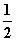
C.m=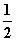 、n=1 D.m=1、n=
、n=1 D.m=1、n=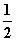
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,可逆反应N2(g)+3H2(g)
 2NH3(g) ΔH<0,达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) ΔH<0,达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆都发生变化且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
C.降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
D.加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
________________________________________________________________________
_______________________________________________________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=________,V6=________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
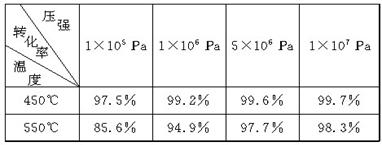
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
(3) 实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4) 在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,对pH=3的醋酸溶液(Ⅰ)和pH=11的氢氧化钠溶液(Ⅱ),下列说法正确的是( )
A.Ⅰ和Ⅱ的物质的量浓度均为0.001 mol·L-1
B.将Ⅰ稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小
C.Ⅰ和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量
D.Ⅰ和Ⅱ等体积混合后,溶液中离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com