
化学与生产、生活、科技等密切相关,下列说法不正确的是
A. 加大清洁能源的开发利用,提高资源的利用率
B. 研发使用高效催化剂,可提高反应中原料的转化率
C. 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物
D. 用沼气、太阳能,风能等新型能源代替化石燃料
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A. 若管道漏气遇氨就会产生白烟 B. 该反应利用了Cl2的强氧化性
C. 该反应属于复分解反应 D. 生成1 mol N2有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源:东北三省四市教研联合体2017届高三高考模拟试卷(一)理综化学试卷 题型:简答题
煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________。
②列式并计算该反应在700℃时的化学平衡常数K=__________,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________(填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4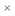 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3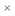 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系不正确的是
选项 | 操作 | 现象 | 结论 |
A | 向溶有SO2的BaCl2溶液中通入气体X | 产生白色沉淀 | X一定是NO2 |
B | 向NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-结合H+能力比CO32-强 |
C | 向NaHCO3溶液中加入醋酸,将产生的气体 直接通入苯酚钠溶液中 | 产生白色沉淀 | 酸性:醋酸>碳酸>苯酚 |
D | 浓度均为0.10mol/L的 Na2CO3和Na2S的混合溶液中滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)>Ksp(Ag2CO3) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列有关实验原理或实验操作正确的是
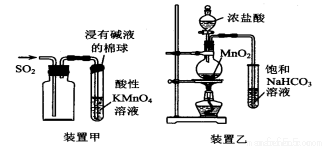
A. 用装置甲收集SO2并验证其漂白性
B. 用装置乙验证氯气与水反应有盐酸生成
C. 用NaOH溶液除去苯中混有的少量苯酚,反应后分液
D. 用澄清石灰水鉴别苏打溶液和小苏打溶液
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:实验题
氧化还原滴定实验与中和滴定类似,是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0. 00lmol/L酸性KMnO4溶液滴定未知浓度的NaHSO3溶液,请回答下列问题:
(1)完成滴定的离子方程式(在__中填系数,在___上填物质或离子):_____
____MnO4-+____HSO3-+____=____Mn2++___ ____+___H2O
(2)该滴定实验的仪器除了铁架台、滴定管夹外,还需要下列用品中的_____(填序号)
A.酸式滴定管 B.碱式滴定管 C.漏斗 D.锥形瓶 E.烧杯 F.白纸
(3) KMnO4溶液不能用____(酸、碱)式滴定管盛装,原因是:_______。
(4)是否需要选择指示剂?_____。滴定终点的现象是___________。
(5)滴定前平视KMnO4液面,刻度为amL,滴定后俯视液面刎度为bmL,则(b-a)mL比实际消耗KMnO4溶液体积_______(填“大”、“小”或“无影响”,下同)。根据(b-a) mL计算,得到NaHSO3的浓度比实际的浓度_______。
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:选择题
下列变化能体现物质的漂白性的是:
A. SO2使酸性KMnO4溶液褪色 B. 乙烯使澳水褪色
C. Na2O2使无色酚酞先变红,后褪色 D. SO2使NaOH酚酞溶液褪色
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
某温度下,H2(g)+CO2(g)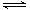 H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=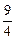 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/ mol·L—1 | 0.010 | 0.020 | 0.020 |
c(CO2)/ mol·L—1 | 0.010 | 0.010 | 0.020 |
下列判断不正确的是
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L—1
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com