
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: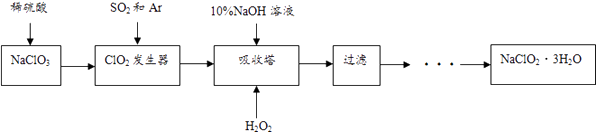
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O
②纯ClO2常温下为气体,易分解爆炸,一般用稀有气体或空气稀释到10%以下安全
(1)10%的NaOH溶液的密度为1.2g/cm3其物质的量浓度为 .
(2)在ClO2发生器中当1gSO2完全转化时,放出akJ热量,写出该热化学反应方程式鼓入Ar的作用是 .
(3)写出吸收塔内发生的化学反应方程式 . 吸收塔的温度不能超过40℃,其目的是 .
(4)从滤液中得到的NaClO23H2O粗晶体中往往含有杂质,要得到更纯的NaClO23H2O晶体方法是 .
(5)工业处理含NaClO2废水时,先向废水中加入适量NaOH,用惰性电极电解该废水,同时制得NaClO3 , 写出ClO2﹣在阳极放电时的电极反应方程式 .
(6)已知SO2和Ar的混合气体中,SO2的百分含量为5.6a%,当bL(标况下)该混合气体参加反应时,理论上需要的17%的H2O2的质量为g(结果必须化简).
【答案】
(1)3mol/L
(2)2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g)△H=﹣64akJ/mol;稀释ClO2防止分解爆炸
(3)H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O;防止H2O2分解
(4)重结晶
(5)ClO2﹣﹣2e﹣+2OH﹣=ClO3﹣+H2O
(6)0.5ab
【解析】解:ClO2在二氧化硫和Ar气混合气体中不易分解爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2 , NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO23H2O.(1)质量分数为10%、密度为1.2g/cm3的NaOH溶液,设氢氧化钠溶液的体积为VL,则m=ρV=1.2g/cm3×V×103ml×10%=1.2V×102g,则n= ![]() =
= ![]() =3Vmol,所以c=
=3Vmol,所以c= ![]() =3mol/L,所以答案是:3mol/L;(2)1gSO2完全转化时,放出akJ热量,1molSO2完全转化时,放出64akJ热量,热化学反应方程式2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g)△H=﹣64akJ/mol;由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入Ar的作用应是稀释ClO2以防止爆炸,
=3mol/L,所以答案是:3mol/L;(2)1gSO2完全转化时,放出akJ热量,1molSO2完全转化时,放出64akJ热量,热化学反应方程式2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g)△H=﹣64akJ/mol;由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.发生器中鼓入Ar的作用应是稀释ClO2以防止爆炸,
所以答案是:2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g)△H=﹣64akJ/mol;稀释ClO2防止分解爆炸;(3)根据流程信息可知,吸收塔内生成NaClO2 , 所以一定有ClO2→NaClO2 , 化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2 . H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,所以答案是:H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O;防止H2O2分解;(4)得到的粗晶体经过重结晶可得到纯度更高的晶体,所以答案是:重结晶;(5)ClO2﹣失电子生成ClO3﹣ , 电极反应方程式:ClO2﹣﹣2e﹣+2OH﹣=ClO3﹣+H2O,所以答案是:ClO2﹣﹣2e﹣+2OH﹣=ClO3﹣+H2O;(6)根据方程式2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g),H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O
可知SO2~H2O2为1:1
设需要的17%的H2O2的质量为x g![]() ×5.6a%=
×5.6a%= ![]()
x=0.5ab
所以答案是:0.5ab.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 煤属于有机化合物
B. 在物质变化类型上,煤的干馏过程包含了物理变化和化学变化
C. 煤中含有大量的苯等芳香烃,煤是芳香烃的主要来源
D. 水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X,Y,Z的物质的量的变化如图所示.则下列有关推断正确的是 ( ) 
A.该反应的化学方程式为3X+2Y2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成下面题目:
(1)写出表示含有8个质子,10个中子的原子的化学符号: .
(2)根据下列微粒回答问题: ![]() H、
H、 ![]() H、
H、 ![]() H、14C、14N、16O、35Cl2、37Cl2 . ①以上8种微粒共有种核素,共种元素.
H、14C、14N、16O、35Cl2、37Cl2 . ①以上8种微粒共有种核素,共种元素.
②互为同位素的是 .
③质量数相等的是和 , 中子数相等的是和 .
(3)相同物质的量的14CO2与S18O2的质量之比为;中子数之比为;电子数之比为 .
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是: . (铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.糖类在一定条件下都可以水解
B.除去油脂中的少量水分,既可以用无水硫酸钠也可以用碱石灰
C.酒中存在的某些微生物可以使部分乙醇发酵,氧化为碳酸,酒就有了酸味
D.氨基酸分子中含有—COOH和—NH2二种原子团,氨基酸分子之间能相互形成复杂的多肽化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、T、W五种元素的性质或原子结构如下表:
元素 | 元素性质或原子结构 |
X | 原子的最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
T | 与Z同周期,元素最高价是+7价 |
W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是;W元素基态原子电子排布式为 .
(2)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是 . A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为 , 它所形成的晶体类型为; Y的常见氢化物易液化的主要原因是
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4.4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为 . ②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
请用离子方程式表示BC段、CD段发生的反应:
BC段:;
CD段: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com