
| 9g |
| 18g/mol |
| 1 |
| 4 |
| 18.4g-0.25mol×16g/mol |
| 32g/mol |
| 9g |
| 18g/mol |
| 1 |
| 4 |
| 18.4g-0.25mol×16g/mol |
| 32g/mol |
|
|
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
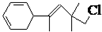 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A、不溶于水 |
| B、属于芳香族化合物 |
| C、在加热和催化剂作用下,最多能和4mol H2反应 |
| D、既能发生氧化反应也能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 拆开化学键 | 形成化学键 | 则上述反应中能量变化是多少(列出计算式)?是放热还是吸热? |
| 2mol H2中的化学键 | 4mol H-O键 | |
| 1mol O2中的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最后所得溶液的物质的量浓度是0.33mol/L |
| B、通过装置①②后气体体积仍为6.72L |
| C、通过装置③后所得气体呈红棕色 |
| D、集气瓶中收集到0.025mol O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com