
 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.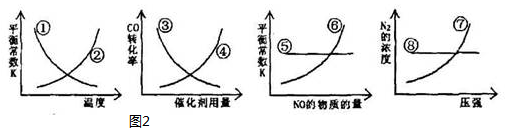
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应的热化学方程式改变系数,焓变随之改变,通过热化学方程式之间的加减计算得到;
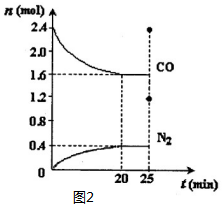
(2)①由图可知,20min到达平衡,平衡时生成氮气为0.4mol,由方程式可知消耗NO为0.4mol×2=0.8mol,转化率=$\frac{物质的量变化量}{起始物质的量}$×100%,根据v=$\frac{△c}{△t}$计算v(NO);
若保持反应温度不变,再向容器中充入CO、N2各0.8mol,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,由平衡常数表达式可知,浓度商Qc>K,平衡逆向移动;
②化学平衡的标志是正逆反应速率相同,各组分含量保持不变,据此分析选项;
③平衡常数只受温度影响,升高温度平衡向吸热反应移动,该反应正反应为放热反应,故升高温度平衡向逆反应移动;
催化剂只改变化学反应速率,不改变化学平衡,物质转化率不变;
平衡常数只受温度影响,温度不变平衡常数不变,与物质的浓度无关;
压强增大,平衡正向进行,增大氮气的物质的量,氮气的浓度增大.
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O(g)△H=-483kJ•mol-1;
③N2(g)+3H2(g)=2NH3(g)△H=-93kJ•mol-1.
根据盖斯定律,②×3+①×2-③×2可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=[3×(-483kJ•mol-1)+(+180.5kJ•mol-1)×2-2×(-93kJ•mol-1)]=-903kJ•mol-1,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-903kJ•mol-1;
(2)①由图可知,20min到达平衡,平衡时生成氮气为0.4mol,由方程式可知消耗NO为0.4mol×2=0.8mol,NO转化率=$\frac{0.8mol}{2.8mol}$×100%=28.57%,v(NO)=$\frac{\frac{0.8mol}{2L}}{20min}$=0.02mol/(L•min),若保持反应温度不变,再向容器中充入CO、N2各0.8mol,
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.
始 2.8mol 2.4mol 0 0
变 0.8mol 0.8mol 0.4mol 0.8mol
终 2.0mol 1.6mol 0.4mol 0.8mol
化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,该温度下的化学平衡常数K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{\frac{0.4}{2}×(\frac{0.8}{2})^{2}}{(\frac{2.0}{2})^{2}×(\frac{1.6}{2})^{2}}$=0.05,25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8mol,
2NO(g)+2CO(g)?N2(g)+2CO2(g)
2 1.6+0.8=2.4 0.8+0.4=1.2 0.4
Q=$\frac{(\frac{0.4}{2})^{2}×\frac{1.2}{2}}{(\frac{2}{2})^{2}×(\frac{2.4}{2})^{2}}$=0.017>K,浓度商Qc>K,平衡逆向移动;
故答案为:28.57%;0.02mol/(L•min);0.05;向左;
②2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.
a. v生成(CO2)表示V正,v消耗(CO)表示V正,所以不能表示到达平衡,故a错误;
b.反应前后都为气体,在密闭容器中,反应前后质量不变,混合气体的密度ρ=$\frac{m}{v}$始终保持不变,所以不能判断,故b错误;
c.反应前后质量不变,但反应后气体的体积减小,所以当混合气体的平均相对分子质量不再改变,能判断达到平衡,故c正确;
d.单位时间内消耗2n mol CO2的表示V逆,同时生成n mol N≡N表示V正,且符合其系数比,能判断达到平衡,故d正确;
e.达到平衡不必必须满足NO、CO、N2、CO2的浓度相等,所以不能判断达到平衡,故e错误;
故答案为:cd;
③平衡常数只受温度影响,升高温度平衡向吸热反应移动,该反应正反应为放热反应,故升高温度平衡向逆反应移动,平衡常数减小,故①正确②错误;
催化剂只改变化学反应速率,不改变化学平衡,物质转化率不变,故③④错误;
平衡常数只受温度影响,温度不变平衡常数不变,与物质的浓度无关,故⑤正确⑥错误;
压强增大,平衡正向进行,增大氮气的物质的量,氮气的浓度增大,⑦正确⑧错误;
综上所述①⑤⑦正确;
故答案为:①⑤⑦.
点评 本题考查了反应热的计算、化学平衡的有关计算、影响平衡常数的因素、化学平衡的移动与图象等,会根据反应方程式计算化学平衡常数,利用化学平衡常数与浓度商的关系确定反应方向,理解外界条件对平衡的影响是解答关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
 某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.| 实验变量 实验序号 | 银氨溶液的S/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH值 | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.
碳元素形成的单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔触的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图所示,该物质的化学式为KC8.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
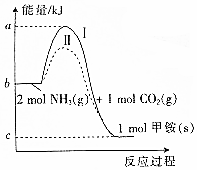 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 33.8 |
| ② | 24.7 | 33.7 |
| ③ | 24.9 | 35.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.
用CO合成尿素的反应为:2NH3(g)+CO(g)?CO(NH2)2(g)+H2(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | CF2=CF2 | C. | CCl2F2 | D. | SF6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-中氯元素显+1价,具有很强的还原性 | |
| B. | 这些离子结合H+的能力,ClO4-最强 | |
| C. | ClO3-是NO3-的等电子体,其空间构型为平面三角形 | |
| D. | ClO2-、ClO3-、ClO4-中的氯原子都采取sp3杂化,离子中相邻两个Cl-O键间键角依次增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com