
(9分)已知(SCN)2是一种与卤素化学性质相似的化合物,称拟卤素,其离子SCN-与X-性质相似,称为拟卤离子,根据这一点,可以设计如下的实验来确定NaBr和NaCl混合物样品的组成。称取0.3672g样品溶于水,加入30.00mL(过量)0.2000mol/L的AgNO3溶液,再加入少量的含有Fe3+的溶液作指示剂,然后用0.1000mol/L的NH4SCN滴定溶液中过量的Ag+,到达终点时用去20.00mL NH4SCN溶液。计算样品中NaCI和NaBr的物质的量之比。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:038
已知(SCN)2是一种与卤素化学性质相似的化合物,称拟卤素,其离子SCN-与X-的性质相似。利用这个性质,可以测定NaBr和NaCl组成的混合物的组成。现称取样品0.3675g,溶于水后,加入30.00 ml(过量)0.2000 mol/L的AgNO3溶液,再加入少量的含Fe3+的溶液作指示剂,然后用0.1000 mol/L的NH4SCN溶液去滴定过量的Ag+。滴至溶液显红色时即到达终点,这时共用去20.00ml NH4SCN溶液。
(1)写出滴定时SCN-分别与Ag+和Fe3+反应的离子方程式。
(2)计算样品中NaCl和NaBr的物质的量的比。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)写出滴定时SCN-分别与Ag+和Fe3+反应的离子方程式。
(2)计算样品中NaCl和NaBr的物质的量的比。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
(1)Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。
①写出基态Fe3+的核外电子排布式 。
②已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
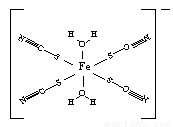
③下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
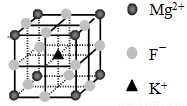
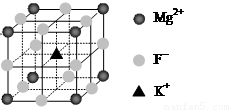
④F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。
(2)氨气是一种重要的化工原料。
①液氨和水类似,也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
为 。
②已知:N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-l
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-908 kJ·mol-l
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式: 。
(3)在下图装置中,若通电一段时间后乙装置左侧电极质量增加。
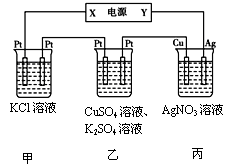
①下列说法错误的是 ;
A.乙中左侧电极反应式:Cu2++2e-=Cu
B.电解一段时间后,装置丙的pH减小
C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态
D.电解一段时间后,向乙中加入0.1molCu(OH)2可使电解质溶液复原,则电路中通过的电子为0.2mol②若将甲中溶液换成MgCl2,则电解总反应的离子方程式为 ;
③若Cu电极上质量增加2.16 g, 甲溶液体积为200mL, 则甲溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州市高三下学期5月考前适应性考试化学试卷(解析版) 题型:填空题
Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物。
(1)写出基态Fe3+的核外电子排布式 。
(2)CN-中碳原子的杂化方式为 。
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
(4)写出一种与SCN-互为等电子体的分子 。(用化学式表示)
(5)下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。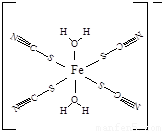
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com