
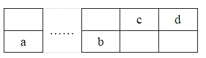
【题目】a、b、c、d四种短周期元素在周期表中的位置如图所示,a和b分别位于周期表的第2列和第13列,下列叙述正确的( )
A.离子半径b>d
B.b可以和强碱溶液发生反应
C.c的最简单氢化物的空间结构为三角锥形
D.a的最高价氧化物对应水化物是强碱
【答案】B
【解析】
根据a、b、c、d四种短周期元素在周期表中的位置,a和b分别位于周期表的第2列和第13列,则a位于第三周期ⅡA族,为Mg元素;b位于第三周期ⅢA族,为Al元素;结合各元素的相对位置可知,c为C元素,d为N元素,据此分析解答。
根据分析可知,a为Mg,b为Al,c为C元素,d为N元素。
A.铝离子和氮离子都含有2个电子层,核电荷数越大,离子半径越小,则离子半径:b<d,故A错误;
B.Al可以与强碱溶液反应生成偏铝酸盐和氢气,故B正确;
C.c的最简单氢化物为甲烷,甲烷为正四面体结构,故C错误;
D.a的最高价氧化物对应水化物为氢氧化镁,氢氧化镁不属于强碱,是中强碱,故D错误;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。某实验兴趣小组将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl![]() 2FeCl2 +C6H4Cl2+HC1↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
2FeCl2 +C6H4Cl2+HC1↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
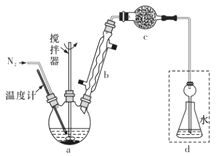
在三颈烧瓶中放入162.5g无水FeCl3与225 g氯苯,控制反应温度在130℃下加热3 h,冷却、过滤,洗涤、干燥得到粗产品。有关数据如表:
C6H5Cl | C6H4Cl2 | AgCl | Ag2CrO4 | |
颜色 | — | — | 白色 | 砖红色 |
溶度积 | — | — | 1.56×10-10 | 9×10-12 |
熔点/℃ | -45 | 53 | — | — |
沸点/℃ | 132 | 173 | — | — |
回答下列问题:
(1)仪器c的名称是_______,盛装的试剂可以是_______________(填字母代号)。
A.碱石灰 B,浓硫酸 C.无水氯化钙 D.固体氢氧化钠
(2)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是______(填字母代号)。
e. 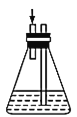 f.
f.  g.
g. 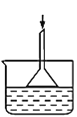 h.
h. 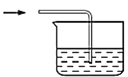
(3)如何从滤液中回收过量的氯苯:__________。
(4)将锥形瓶内的溶液稀释至1 000 mL,从中取出10. 00 mL,滴加几滴K2CrO4 作指示剂,用0. 200 0 mol/L AgNO3溶液进行滴定,当达到终点时平均消耗22. 50 mL AgNO3溶液。
①滴定终点的现象是________,使用棕色滴定管进行滴定的目的是_________。
②无水FeCl3的转化率α=_______
③上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关。下列说法错误的是( )
A.蚕丝属于天然高分子材料
B.雾霾纪录片《穹顶之下》,提醒人们必须十分重视环境问题,提倡资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle)
C.化石燃料完全燃烧不会造成大气污染
D.中国古代用明矾溶液清洗铜镜表面的铜锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行下列实验时,温度计水银球置于反应物液面以下的是 ( )
A.乙醇和浓硫酸混合加热到170°C制乙烯B.从石油中提炼汽油
C.用蒸馏方法提纯水D.实验室制取硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水(主要以H3AsO3形式存在)提取As2O3的工艺流程如下:
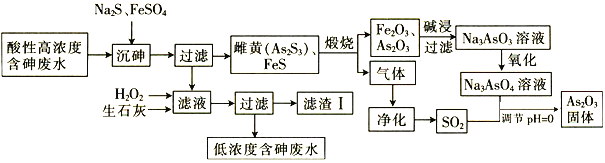
回答下列问题:
(1)上述流程的_____过程中由于条件的原因,造成生成物中混有Fe3O4,为证明Fe3O4的存在,可利用Fe3O4具有_______性的这一物理性质。
(2)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为________。
(3)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:
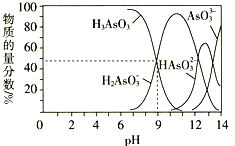
①H3AsO3为_______元_______(填“强”或“弱”)酸。
②pH由7调节至10的过程中发生反应的离子方程式为__________。
③H3AsO3的一级电离平衡常数Ka1=__________。
(4)滤渣Ⅰ中含有FeAsO4、Fe(OH)3、Ca3(AsO4)2和 _______(填化学式);已知Ksp[FeAsO4]=5.7×10-21 ,含砷污染物允许排放标准为不大于0.5 mgL-1。若低浓度含砷废水(假设砷均以Na3AsO4形式存在)中Fe3+的浓度为1. 0×10-4 molL-1 ,则低浓度含砷废水中Na3AsO4的浓度为_____ mgL-1,_____(填“符合”或“不符合”)排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中离子的数目减小
B. 再加入CH3COONa固体能促进醋酸的电离
C. 醋酸的电离程度增大,c(H+)亦增大
D. 溶液中c(CH3COO-)/c(CH3COOH)c(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石中的碳化钙和水能完全反应:CaC2+2H2O=C2H2↑+Ca(OH)2使反应产生的气体排水,测量排出水的体积,可计算出标准状况下乙炔的体积,从而可测定电石中碳化钙的含量。
(1)若用下列仪器和导管组装实验装置
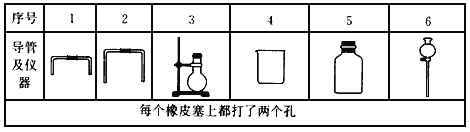
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:____接____接____接____接____接____。
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不产生气体时,关闭活塞。
正确的操作顺序(用操作编号填写)是__________________。
(3)若实验产生的气体有难闻气味,且测定结果偏大,这是因为电石中含有___________杂质。
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数是_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(化合物L)是人们熟知的解热镇痛药物。一种长效、缓释阿司匹林(化合物P,其结构简式为 )的合成路线如图所示:
)的合成路线如图所示:

已知:①HC![]() CH+RCOOH
CH+RCOOH![]()
②RCOOR’+R”OH![]() RCOOR”+R’OH(R、R’、R”代表烃基)
RCOOR”+R’OH(R、R’、R”代表烃基)
(1)A中的官能团是___。
(2)C的结构简式是___。
(3)D→E的反应类型是___。
(4)E→G的化学方程式___。
(5)已知:H是芳香族化合物。L在体内可较快转化为具有药效的J,而化合物P与L相比,在体内能缓慢持续释放J。
①血液中J浓度过高能使人中毒,可静脉滴注NaHCO3溶液解毒。请用化学方程式解释NaHCO3的作用___。
②写出J→L的化学方程式___。此反应的副反应是J自身发生缩聚,写出副产物的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下 :(废料中的其他金属含量较低,对实验影响可忽略)

已知:① AgCl可溶于氨水,生成[Ag(NH3)2]+;
② Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取____________措施(写出其中一种即可)。
(2)操作IV经过_______________、_________________、过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是________________________________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为_________________________________(其中AgCl和NaCl的物质的量之比为2:1)。氧化的同时发生沉淀转化,离子方程式为______________________________,其平衡常数K=_____________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com