
| A. | 新制的氯水滴到蓝色的石蕊试纸上,试纸由蓝色变红色,最后变无色 | |
| B. | 变色镜遇强光颜色变深主要是由于卤化银见光分解而造成的 | |
| C. | 用有机溶剂就可以从碘水中提取碘单质 | |
| D. | C1-、Br-、I-的还原性随着核电荷数的增大而增强 |
分析 A.氯水中含有盐酸和次氯酸,溶液呈酸性,次氯酸漂白性;
B.变色镜遇强光颜色变深主要是由于AgBr见光分解而造成的;
C.乙醇不能作碘水中的萃取剂;
D.卤族元素中,元素的非金属性越强,其简单阴离子的还原性越弱.
解答 解:A.氯水中含有盐酸和次氯酸,溶液呈酸性,次氯酸漂白性,所以新制的氯水滴到蓝色的石蕊试纸上,因为溶液有酸性导致试纸由蓝色变红色,因为次氯酸的漂白性导致最后变无色,故A正确;
B.变色镜遇强光颜色变深主要是由于AgBr见光分解生成Ag和溴,故B正确;
C.乙醇不能作碘水中的萃取剂,所以并不是所有的有机物能作碘水的萃取剂,故C错误;
D.卤族元素中,元素的非金属性越强,其简单阴离子的还原性越弱,非金属性Cl>Br>I,所以C1-、Br-、I-的还原性随着核电荷数的增大而增强,故D正确;
故选C.
点评 本题以卤族元素为载体考查萃取、元素周期律、氯水性质,为高频考点,明确物质性质及基本操作原理是解本题关键,注意萃取剂的选取方法及次氯酸的漂白性,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| B. | 绿色化学的核心是在化学合成中将原子充分利用,从源头上减少或消除污染 | |
| C. | 高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用 | |
| D. | SO2是大气污染物,但葡萄酒中都含有一定量的SO2,SO2既可杀菌又可用来保鲜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 将10mL pH=a的盐酸与100mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 | |
| C. | 将pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合,混合后溶液的pH=10.7(已知lg2=0.3) | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合后所得溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始量 | 甲 | 乙 | 丙 |
| H2 (mol) | 1 | 2 | 2 |
| CO2(mol) | 1 | 1 | 2 |
| A. | 反应开始时,甲中的反应速率最慢,丙中的反应速率最快 | |
| B. | 平衡时,甲和丙中CO2的转化率相等,均是60% | |
| C. | 平衡时,乙中H2的转化率大于60% | |
| D. | 平衡时,丙中c(H2)是0.08 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
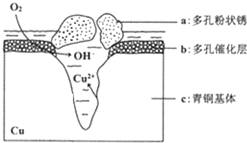 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )| A. | 腐蚀过程中,负极是a | |
| B. | 正极反应是 O2+4e-+2H2O═4OH- | |
| C. | 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况) | |
| D. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com