
下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是
2H2(g)+O2(g)===2H2O(l) ΔH=-483.6 kJ
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
下列有关说法正确的是
A.SiO2是酸性氧化物,所以SiO2能与NaOH溶液反应
B.SO2可以使溴水褪色,所以SO2具有漂白性
C.若某碱性溶液的焰色反应呈黄色,则该溶液的溶质一定为NaOH
D.NH3的水溶液可以导电,所以NH3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
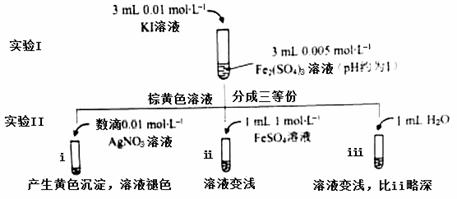
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
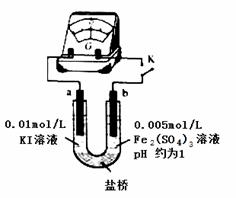
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
今有:①纯净的碳酸钠ag;②碳酸钠与碳酸氢钠的混合物ag.两者相比,下列各种情况的描述正确的是()
| A. | 分别和盐酸完全反应时,混合物的耗酸量多 | |
| B. | 分别和盐酸完全反应时,纯净的碳酸钠放出的CO2多 | |
| C. | 分别溶于水,再加入足量澄清石灰水,混合物得到的沉淀质量大 | |
| D. | 分别配成等体积的溶液,混合物溶液的Na+的物质的量浓度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有HCO3﹣、SO32﹣、CO32﹣、CH3COO﹣4种阴离子.若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是()
| A. | CH3COO﹣ | B. | SO32﹣ | C. | CO32﹣ | D. | HCO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ·mol-1,则关于热化学方程式:2H2O(l)===2H2(g)+O2(g) ΔH2=?的说法中正确的是( )
A.热化学方程式中化学计量数表示分子数
B.该反应ΔH2大于零
C.该反应的ΔH2=-571.6 kJ·mol-1
D.该反应可表示36 g水分解时的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
己知丙烷的燃烧热△H=-2215KJ·mol-1,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
A.55 kJ B.220 kJ C. 550 kJ D.1108 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com