
分析 (1)标准状况下89.6升O2的物质的量:$\frac{89.6L}{22.4L/mol}$=4mol,
①过氧化氢分解生成水和氧气是电子的转移发生在同种元素的原子之间;
②高锰酸钾受热分解是电子的转移发生在不同种元素原子之间;
(2)反应为SO2+2H2S=3S↓+2H2O氧化产物和还原产物都是S,且二者物质的量之比为2:1,氧化产物比还原产物多32g,则氧化产物比还原产物多的物质的量为$\frac{32g}{32g/mol}$=1mol,当氧化产物比还原产物多1mol时参加反应的二氧化硫的物质的量为1mol;
(3)原溶液中的SO42-恰好完全沉淀,则硫酸氢钠和氢氧化钡应该以1:1反应,二者反应生成硫酸钡、氢氧化钠和水;
解答 解:(1)标准状况下89.6升O2的物质的量:$\frac{89.6L}{22.4L/mol}$=4mol,
①过氧化氢分解生成水和氧气是电子的转移发生在同种元素的原子之间,反应的化学方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,生成1mol氧气转移2mol的电子,所以 转移电子数为 8×6.02×1023;故答案为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;8×6.02×1023;
②高锰酸钾受热分解是电子的转移发生在不同种元素原子之间,反应的化学方程式为:2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,生成1mol氧气转移4mol的电子,所以 转移电子数为 16×6.02×1023;故答案为:2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;16×6.02×1023;
(2)反应为SO2+2H2S=3S↓+2H2O氧化产物和还原产物都是S,且二者物质的量之比为2:1,氧化产物比还原产物多32g,则氧化产物比还原产物多的物质的量为$\frac{32g}{32g/mol}$=1mol,当氧化产物比还原产物多1mol时参加反应的二氧化硫的物质的量为1mol,水的物质的量为2mol,质量为36g,硫化氢的物质的量为2mol,体积为:44.8L,故答案为:36g;44.8L;
(3)原溶液中的SO42-恰好完全沉淀,则硫酸氢钠和氢氧化钡应该以1:1反应,二者反应生成硫酸钡、氢氧化钠和水,离子方程式为H++SO42-+OH-+Ba2+=BaSO4+H2O,所以 Ba(OH)2溶液的体积为100mL,过滤后,溶液中溶质硫酸的物质的量浓度是0.05mol/L,故答案为:0.05mol/L.
点评 本题考查氧化还原反应方程式的书写和氧化还原反应的有关计算,为高频考点,侧重于学生分析、计算能力的考查,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5mol/L NaCl溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 300mL 5mol/L KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯萃取碘水中的I2,分出水层的操作为从上口倒出 | |
| B. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 配制245mL0.1 mol•L-1的NaOH溶液,需要245mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
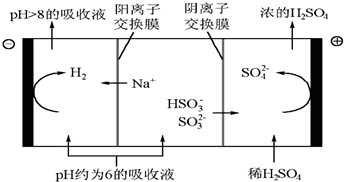
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发过程中用玻璃棒不断搅拌 | |
| B. | 先用酒精灯加热蒸发皿,再将滤液倒入蒸发皿中 | |
| C. | 当加热至蒸发皿中有较多固体析出时停止加热,利用余热将液体蒸干 | |
| D. | 蒸发完成时,用坩埚钳把蒸发皿移至石棉网上 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该元素位于元素周期表中第四周期ⅣB族 | |
| B. | 该元素位于s区 | |
| C. | 该元素的最高化合价为+2价 | |
| D. | 该元素基态原子中能量最高的是3d电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚四氟乙烯的单体是不饱和烃 | |
| B. | 聚四氟乙烯中含有碳碳双键 | |
| C. | 聚四氟乙烯有固定熔点 | |
| D. | 四氟乙烯中既含有极性键又含有非极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com