
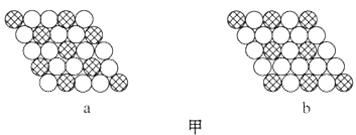
【题目】(1)如图甲所示为二维平面晶体示意图,所表示物质的化学式为AX3的是__________。
(2)图乙为一个金属铜的晶胞,请完成以下各题。
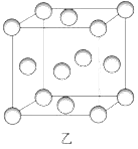
①该晶胞“实际”拥有的铜原子数是_________个。
②该晶胞称为_____________。(填序号)
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
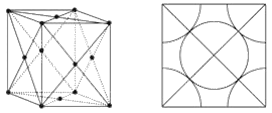
③我们在晶体结构中可以划出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个侧面上,(图示如下图)这类金属晶体中原子的空间利用率是_____________。
【答案】b 4 C 74%
【解析】
(1) a:每个白色小球被3个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为3:6=1:2,则化学式为AX2;
b:每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为2:6=1:3,则化学式为AX3;
故答案为b;
(2)①用“切割分摊法”可知,顶点的铜原子被8个晶胞占有,面心的铜原子被2个晶胞占有,该晶胞“实际”拥有的铜原子数是8×1/8+6×1/2=4;
故答案为4;
②铜原子位于晶胞的顶点和面心,该晶胞称为面心立方晶胞;
故答案为:C;
③根据侧面图可知,晶胞面心的铜原子与顶点的铜原子相切,设正立方体边长为a,则晶胞体积为a3,铜原子半径![]() ,每个正立方体包括金属原子8×1/8+6×1/2=4(个),铜原子的总体积,即球体体积共
,每个正立方体包括金属原子8×1/8+6×1/2=4(个),铜原子的总体积,即球体体积共![]() ,则空间利用率为
,则空间利用率为![]() ;
;
故答案为:74%。


科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断正确的是
( )
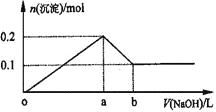
A.混合溶液中Al3+的物质的量为0.2mol
B.NaOH的浓度为0.5 mol/L
C.在b点处溶液中的溶质只有NaAlO2
D.图中线段oa:ab=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是
①1∶3 ②2∶3 ③1∶4 ④2∶7 ⑤任意比
A.①④B.⑤C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )

A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、将 5 g 钠铝合金投入到 200 mL 的水中,固体完全溶解,产生 4.48 L 标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为_______,所得溶液中溶质的物质的量浓度为__________(假设溶液体积变化忽略不计)。
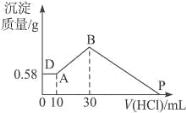
Ⅱ、把由 NaOH、AlCl3、MgCl2 三种固体组成的混合物溶于足量水中,有 0.58 g 白色难溶物析出,向所 得溶液中逐滴加人 0.5 mol L-1 的盐酸,加入盐酸的体积和生成沉淀的质量如下图所示:
请计算:
(1)混合物中 MgCl2 的质量__________g;
(2)P 点表示盐酸加入的体积_________ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl晶体中Na+与Cl-都是等距离交错排列,若食盐的密度是2.2 g·cm-3,阿伏加德罗常数6.02×1023mol-1,食盐的摩尔质量为58.5 g·mol-1。则食盐晶体中两个距离最近的钠离子中心间的距离是多少?_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;该反应在________(填“高温”“低温”“任意温度”)可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。tmin中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)图1为1000K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图像。请分析图1曲线中c(SO2)在0~t2区间变化的原因___________________。

(4)图2为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比![]() 与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
A.当气体的平均密度不再变化,反应I和反应Ⅱ同时达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
D.向混合气体中通入氧气(不考虑与SO2反应),可有效降低SO2体积分数,提高脱硫效率
(5)图1中,t2时刻将容器体积减小至原来的一半,t3时达到新的平衡,请在图1中画出t2-t3区间c(SO2)的变化曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是
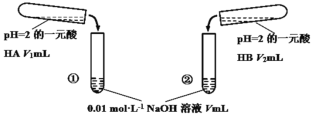
A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能溶液呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com