
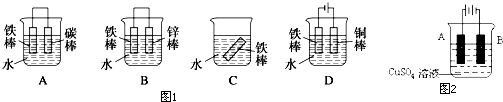
| 1 |
| 2 |
| 2.56g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、Al(OH)3与过量的浓氨水反应生成NH4AlO2 |
| B、Al(OH)3是难溶于水的白色胶状物质 |
| C、Al(OH)3胶体能凝聚水中的悬浮物 |
| D、Al(OH)3受热能分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量的氨水 |
| B、MgCl2溶液中加入过量的氨水 |
| C、Al2(SO4)3溶液中加入过量的KOH溶液 |
| D、MgSO4溶液中加入过量的KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I-、ClO-、H+、Na+ |
| B、K+、HCO3-、OH-、NH4+ |
| C、Fe3+、Cu2+、SO42-、Cl- |
| D、Ca2+、Na+、SO42-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表第8、9、10三纵列合称Ⅷ族,Ⅷ族是元素周期表所有族中元素种类最多的族 |
| B、元素周期表中的所有副族元素都是金属元素,副族包含过渡元素和Ⅷ族 |
| C、在同一主族中,从上到下,F、Cl、Br、I的非金属性逐渐减弱 |
| D、因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
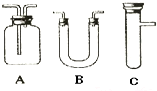 浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C
浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C
| ||
| 选用的仪器 (填字母) | 加入的试剂 | 作用 |
| C | 浓H2SO4、木炭 | 发生反应 |
| B | 检验产物水 | |
| A | 检验SO2 | |
| A | 酸性KMnO4溶液 | |
| A | 品红 | |
| A | 检验CO2的存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com