

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
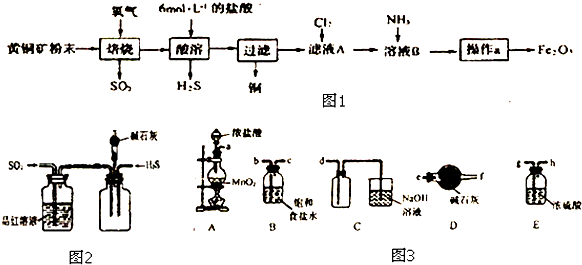
分析 用2mol/L H2SO4溶液溶解草酸亚铁样品将其变成溶液,加热至70℃左右,加入足量的KMnO4溶液发生反应Ⅰ,将溶液中的草酸根氧化成二氧化碳,将二价铁氧化成三价铁,保温放置30min的目的是使反应更完全,再加入试剂A调节pH值,只使三价铁完全生成氢氧化铁沉淀,过滤得到氢氧化铁沉淀,充分灼烧使氢氧化铁分解生成氧化铁,称其质量,最终根据铁守恒计算,据此分析解答.
解答 解:用2mol/L H2SO4溶液溶解草酸亚铁样品将其变成溶液,加热至70℃左右,加入足量的KMnO4溶液发生反应Ⅰ,将溶液中的草酸根氧化成二氧化碳,将二价铁氧化成三价铁,保温放置30min的目的是使反应更完全,再加入试剂A调节pH值,只使三价铁完全生成氢氧化铁沉淀,过滤得到氢氧化铁沉淀,充分灼烧使氢氧化铁分解生成氧化铁,称其质量,最终根据铁守恒计算,
(1)因为Fe2+水解,所以用2mol/L H2SO4溶液溶解草酸亚铁样品而不用蒸馏水直接溶解的原因是防止Fe2+水解,加热至70℃左右,加入足量的KMnO4溶液,将溶液中的草酸根氧化成二氧化碳,将二价铁氧化成三价铁,离子方程式分别为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O和MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
故答案为:防止Fe2+水解; MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
(2)保温放置30min的目的是使反应更完全,故答案为:使反应更完全;
(3)加入足量的KMnO4溶液发生反应Ⅰ,将溶液中的草酸根氧化成二氧化碳,将二价铁氧化成三价铁,所以当高锰酸根过量时即溶液呈紫红色或者不含三价铁即取少许紫红色溶液于试管中,滴加KSCN溶液,溶液颜色无明显变化,则反应Ⅰ完全,故答案为:溶液呈紫红色,取少许紫红色溶液于试管中,滴加KSCN溶液,溶液颜色无明显变化;
(4)因为有沉淀图表可知,三价铁完全沉淀的pH值为4,所以c(Fe3+)=$\frac{Ksp}{c(OH{\;}^{-}){\;}^{3}}$=$\frac{1.1×10{\;}^{-36}}{(1×10{\;}^{-10}){\;}^{3}}$=1.1×10-6 mol•L-1,故答案为:1.1×10-6;
(5)灼烧充分是指氢氧化铁完全分解,即连续两次灼烧、冷却、称量所得质量差不超过0.1g,所以灼烧充分的标志是连续两次灼烧、冷却、称量所得质量差不超过0.1g,故答案为:连续两次灼烧、冷却、称量所得质量差不超过0.1g;
(6)充分灼烧使氢氧化铁分解生成氧化铁,称其质量为8g,即氧化铁的物质的量为$\frac{8g}{160g/mol}$=0.05mol,根据铁守恒,所以样品中FeC2O4的物质的量为0.05×2=0.1mol,则样品中FeC2O4的含量为$\frac{0.1×(56+24+64)}{20.0}$×100%=72%,故答案为:72%.
点评 本题考查了用流程图法测定该样品中FeC2O4的含量,涉及了实验方案设计、方程式的书写、质量分数的计算等知识,可以根据所学知识完成,难度中等.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
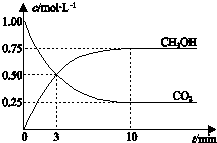
| A. | 升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
已知某化学反应的平衡常数表达式为K=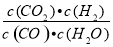 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D.若平衡浓度符合下列关系式: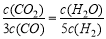 ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:实验题
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
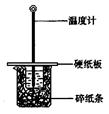
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会 __ __
(5)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 (g)+ 3 H2 (g) = 2 NH3(g) ΔH = - 92.4 KJ/mol,则N≡ N键的 键 能 是
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
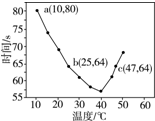
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中b、c两点对应的NaHSO3的反应速率相等 | |
| C. | 图中a点对应的NaHSO3的反应速率为5.0×10-5 mol•(L•s)-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com