
| A. | 22.4L的CO气体1molN2所含的电子数也相等 | |
| B. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 标准情况下将2.24LCl2通入到2L水中,充分反应后转移的电子数且小于0.1NA | |
| D. | 300mL2mol•L-1蔗糖溶液中所含分子数为0.6NA |
分析 A.气体状况未知;
B.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;
C.氯气与水反应生成氯化氢和次氯酸,反应为歧化反应,且为可逆反应;
D.蔗糖溶液中存在蔗糖分子、水分子.
解答 解:A.气体状况未知,Vm不确定,无法计算气体的物质的量,故A错误;
B.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;7.8g Na2S和Na2O2的混合物物质的量为0.1mol,含有的阴离子数为0.1NA,故B错误;
C.标准情况下将2.24LCl2通入到2L水中,因为氯气与水的反应为可逆反应,不能进行到底,所以充分反应后转移的电子数小于0.1NA,故C正确;
D.蔗糖溶液中存在蔗糖分子、水分子,所以300mL2mol•L-1蔗糖溶液中所含分子数远远大于0.6NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题题量较大,涉及的知识点较多,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
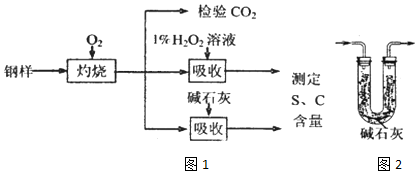
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
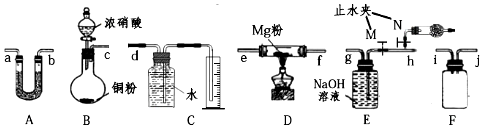
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14 | |
| B. | 将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸 | |
| C. | 测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| D. | 0.2 mol•L-1 H2A 溶液中的 c(H+)=a,0.1 mol•L-1 H2A溶液中的 c(H+)=b,若a<2 b,则H2A为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
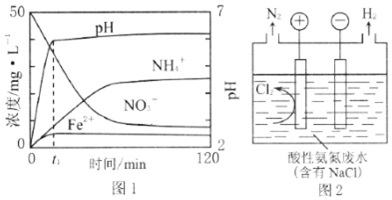
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,Zn板应与外接电源的负极相连 | |
| B. | 放电时,溶液中的OH从正极向负极移动 | |
| C. | 正极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OH- | |
| D. | 充电时,当转移0.2mol电子时,阴极质量增加3.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结 论 |
| A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液,溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol•L-1,MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液,白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com