
| | 实 验 | 现 象 | 离子方程式 |
| A |  | 在空气中放置一段时间后溶液呈蓝色 | 4H+ + 4I- + O2 ="=" 2I2 + 2H2O |
| B |  | 开始时无气泡,后来有气泡 | CO32-+H+=HCO3- HCO3-+H+ ="=" H2O+CO2↑ |
| C |  | 溶液由黄绿色变为无色 | Cl2 + 2OH- ="=" Cl- + ClO- + H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-="=" BaSO4↓+H2O |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| 4-6 |
| 3-6 |
A.Fe3+>Br2>I2>Fe(CN)
| B.Br2>I2>Fe3+>Fe(CN)
| ||||
C.Br2>Fe3+>I2>Fe(CN)
| D.Fe(CN)
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性氢氧燃料电池的正极反应:H2 - 2e- + 2OH-="==" 2H2O |
B.用电子式表示NaCl的形成过程: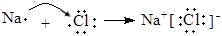 |
| C.向含有Hg2+的废水中加入Na2S可除去Hg2+:Hg2+ + S2- ="==" HgS↓ |
D.汽车尾气系统的催化转化器可降低NO等的排放:2CO+ 2NO 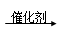 2CO2 +N2 2CO2 +N2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀硝酸与氢氧化钾溶液反应H++OH-=H2O |
| B.铝与稀盐酸反应Al+2H+=Al3++H2↑ |
| C.三氯化铁溶液与氢氧化钠溶液反应FeCl3+3OH-=Fe(OH)3↓+3Cl- |
| D.二氧化碳与石灰水反应CO2+2OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O |
| B.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH- = CaCO3↓+CO32-+2H2O |
| C.向Ca(ClO)2溶液中通入过量的 SO2:C1O- + SO2 + H2O =" HClO" + HSO3- |
| D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2 = 2Fe3++2OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在硫化钠溶液中加入足量稀硝酸: S2-+ 2H+ = H2S↑ |
| B.往氯化铁溶液中通入硫化氢气体: 2Fe3++ S2-= 2Fe2++ S↓ |
| C.用惰性电极电解饱和食盐水:2Cl-+2H2O通电2OH-+ H2↑ + Cl2↑ |
D.乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH CH3COO-+NH4++2Ag↓+3NH3+H2O CH3COO-+NH4++2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。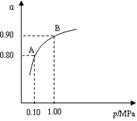
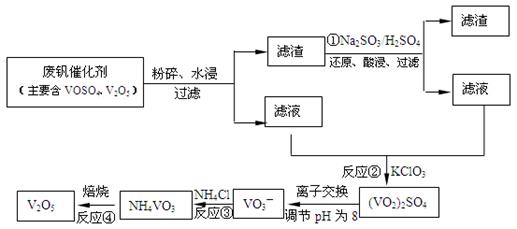
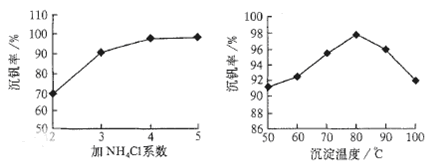
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com