
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
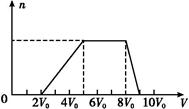
| Cl2的体积(标准状况) | 11.2 L | 22.4 L | 28.0 L |
| n(Cl-) | 2.5 mol | 3.5 mol | 4.0 mol |
| n(Br-) | 3.0 mol | 2.5 mol | 2.0 mol |
| n(I-) | x mol | 0 | 0 |
 AlO2—+2H2O
AlO2—+2H2O 8Cl-+Br2+3I2
8Cl-+Br2+3I2 AlO2—+2H2O。
AlO2—+2H2O。 I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol="0.5" mol 的Br-被氧化:Cl2+2Br-
I2+2Cl-,生成1 mol Cl-,Cl-初始物质的量是(2.5-1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2 22.4 L时,3.0 mol-2.5 mol="0.5" mol 的Br-被氧化:Cl2+2Br- Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I-
Br2+2Cl-,消耗Cl2 0.25 mol,所以Cl2+2I- I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol="0.75" mol,因此原溶液中的I-为:0.75 mol×2="1.5" mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I-
I2+2Cl-,该反应消耗的Cl2为:1 mol-0.25 mol="0.75" mol,因此原溶液中的I-为:0.75 mol×2="1.5" mol,故原溶液中的Cl-、Br-、I-的物质的量浓度之比为1.5∶3∶1.5=1∶2∶1。通入Cl2 22.4 L时,此时参加反应的Cl2、Br-、I-物质的量之比为:1 mol∶0.5 mol∶1.5 mol=2∶1∶3=4∶2∶6,故离子方程式为:4Cl2+2Br-+6I- 8Cl-+Br2+3I2。
8Cl-+Br2+3I2。

科目:高中化学 来源:不详 题型:单选题
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH的溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中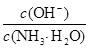 增大 增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
| B.无色溶液中:Mg2+、MnO4-、SO42-、K+ |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(ClO-)=" 1.0" mol/L的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在加入铝粉能产生氢气的溶液中:Al3+、 Fe2+、SO42-、NO3- |
| B.0.1 mol·L-1NaAlO2溶液: H+、Na+、Cl-、SO42- |
| C.在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| D.0.1 mol·L-1 CuSO4溶液:H+、K+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H+、Ba2+、Fe3+、NO3—,通入SO2气体 |
| B.Ca2+、Cl-、K+、H+,通入CO2气体 |
| C.AlO2—、Na+、Br-、SO42—,通入CO2气体 |
| D.HCO3—、Na+、I-、HS-,加入AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+ |
| 阴离子 | OH-、NO3—、I-、HCO3—、AlO2—、HSO4— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
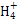 、Cl-、S2-
、Cl-、S2-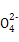 、K+
、K+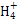 、Na+、Cl-、Cu2+
、Na+、Cl-、Cu2+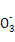 、Mn
、Mn
| A.②③ | B.①③ | C.③④ | D.①⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH<7 |
| B.溶质为NaHCO3 |
| C.2c(Na+)=3[c(H2CO3)+c(HCO3—)+c(CO32—)] |
| D.c(Na+)>c(CO32—)>c(HCO3—)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com