
| A. | 原子半径由大到小的顺序为Z>X>Y | |
| B. | Z元素的氢化物是一种强酸 | |
| C. | 元素非金属性由强到弱的顺序为X>Y>Z | |
| D. | 3种元素的气态氢化物中,Y的气态氢化物还原性最强 |
分析 X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,最外层最多容纳8个电子,则X只能含有2个电子层,最外层含有6个电子,为O元素;X、Z位于同一主族,则Z为S元素;X原子的核外电子数比Y原子少1,则Y的质子数为9,为F元素,据此结合元素周期律知识解答.
解答 解:X、Y、Z是3种短周期元素,X原子的最外层电子数是其电子层数的3倍,最外层最多容纳8个电子,则X只能含有2个电子层,最外层含有6个电子,为O元素;X、Z位于同一主族,则Z为S元素;X原子的核外电子数比Y原子少1,则Y的质子数为9,为F元素,
A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径大小为:Z>X>Y,故A正确;
B.Z为S元素,其氢化物为硫化氢,硫化氢为弱酸,故B错误;
C.同一主族,原子序数越大,非金属性越弱,非金属性X>Z;同一周期,原子序数越大,非金属性越强,则非金属性X<Y,所以三种元素的非金属性大小为:Y>X>Z,故C错误;
D.非金属性越强,氢化物的稳定性越弱,非金属性Y>X>Z,则氢化物的还原性最强的为Z,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题侧重考查学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 道尔顿-葡萄干面包模型 | B. | 卢瑟福-行星模型 | ||
| C. | 汤姆逊-电子轨道模型 | D. | 居里夫人-量子力学模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 研究人员研制出一种可在一分钟内完成充放电的超长性能铝离子电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如图所示.下列说法正确的是( )
研究人员研制出一种可在一分钟内完成充放电的超长性能铝离子电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如图所示.下列说法正确的是( )| A. | 放电时,电子由石墨(Cn)电极经用电器流向铝电极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 充电时,铝电极上发生氧化反应 | |
| D. | 放电时,负极的电极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤、石油、沼气属于人类利用的主要化石燃料 | |
| B. | 煤干馏是复杂的物理化学变化,可得到焦炭、煤焦油和焦炉煤气等 | |
| C. | 氢气是一种清洁能源 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
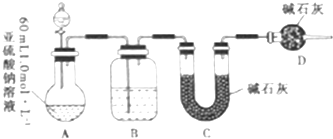
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的还原性:HI>H2SO3>HCl | |
| B. | HI与H2SO3的物质的量浓度为0.6 mol•L-1 | |
| C. | 通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O=4SO42-+I2+10Cl-+16H+ | |
| D. | 若再通入0.05molCl2,恰好能将HI和H2SO3完全氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
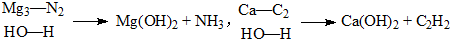
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com