
分析 (1)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(2)①物质的量浓度相等的酸,硫酸和氯化氢是强电解质,完全电离,醋酸是一元弱酸,部分电离;
②酸能电离出来的氢离子的总物质的量越多,生成的氢气越多;
③加水促进醋酸的电离,氢离子浓度变化不大,加水稀释盐酸和硫酸中氢离子浓度变化相同;
④根据电荷守恒分析.
解答 解:(1)④氯化铁为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,
故答案为:④②③①;
(2)①氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以三种溶液的物质的量浓度由大到小的顺序是c>a>b,
故答案为:c>a>b;
②酸能电离出来的氢离子的总物质的量越多,生成的氢气越多,三种溶液能电离的氢离子的总物质的量由大到小的顺序是c>a=b,故答案为:c>a=b;
③加水促进醋酸的电离,氢离子浓度变化不大,加水稀释盐酸和硫酸中氢离子浓度变化相同,所以氢离子浓度相同的醋酸、盐酸和硫酸溶液,加水稀释至原来的100倍后,c(H+)由大到小的顺序是c>a=b;
故答案为:c>a=b;
④pH均为2的醋酸和盐酸溶液中氢离子浓度均为0.01mol/L,由电荷守恒可知c(Cl-)=c(CH3COO-);
故答案为:c(Cl-)=c(CH3COO-).
点评 本题考查了弱电解质的电离及溶液中离子浓度大小的比较,根据电解质的强弱及酸的元数来分析解答即可,难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:多选题
| A. | H3PO3的结构为 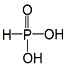 | |
| B. | H3AsO3的结构为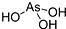 | |
| C. | H3AsO3与H3PO3一样,也为二元酸 | |
| D. | H3AsO3为三元酸,且价层电子对构型为正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时作阳极,放电时作负极 | B. | 充电时作阳极,放电时作正极 | ||
| C. | 充电时作阴极,放电时作负极 | D. | 充电时作阴极,放电时作正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
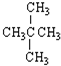 ⑥
⑥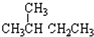 ⑦H2 ⑧D2 ⑨O2 ⑩O3⑪${\;}_{6}^{12}$C⑫${\;}_{6}^{13}$C
⑦H2 ⑧D2 ⑨O2 ⑩O3⑪${\;}_{6}^{12}$C⑫${\;}_{6}^{13}$C查看答案和解析>>
科目:高中化学 来源: 题型:解答题
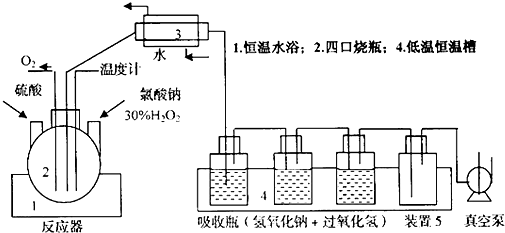
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
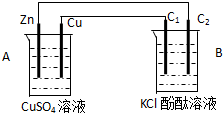 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y>Z | B. | 非金属性X>Y>Z | ||
| C. | 气态氢化物的稳定性HX<H2Y<H3Z | D. | 原子序数 X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2V L | B. | 2.5VL | C. | 3VL | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH增大 | B. | 锌片的质量减轻 | ||
| C. | 溶液中的SO42-浓度增大 | D. | 溶液的密度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com