
分析 (1)pH相同溶液中氢离子浓度相同,醋酸是一元弱酸,硫酸是二元强酸、盐酸是一元强酸,据此判断;
(2)浓度相同,溶液pH与溶液中氢离子浓度成反比;
(3)中和等量氢氧化钠,消失同浓度酸的体积与酸电离出最终氢离子的浓度成反比;
(4)pH相同溶液中氢离子浓度相同,醋酸是一元弱酸,硫酸是二元强酸、盐酸是一元强酸,根据最终能电离的氢离子的总量分析.
解答 解:(1)pH相同溶液中氢离子浓度相同,醋酸是一元弱酸,硫酸是二元强酸、盐酸是一元强酸,假设氢离子浓度为1mol/L,则醋酸浓度大于1mol/L、盐酸浓度是1mol/L、硫酸浓度是0.5mol/L,所以其物质的量浓度的由大到小排列是 ①>②>③;
故答案为:①>②>③;
(2)当它们的物质的量浓度相同时,假设都是1mol/L,醋酸中氢离子浓度小于1mol/L、硫酸中氢离子浓度是2mol/L、盐酸中氢离子浓度是1mol/L,氢离子浓度越大pH越小,所以其pH的由大到小排列是①>②>③;
故答案为:①>②>③;
(3)中和等量氢氧化钠,消失同浓度酸的体积与酸电离出最终氢离子的浓度成反比,三种溶液浓度相等,硫酸是二元酸、醋酸和盐酸都是一元酸,所以最终电离出氢离子的浓度硫酸>醋酸=盐酸,所以消耗三种酸的体积大小顺序是①=②>③,
故答案为:①=②>③;
(4)pH相同溶液中氢离子浓度相同,醋酸是一元弱酸,硫酸是二元强酸、盐酸是一元强酸,假设氢离子浓度为1mol/L,则醋酸浓度大于1mol/L、盐酸浓度是1mol/L、硫酸浓度是0.5mol/L,分别与足量锌粉反应,盐酸与硫酸反应生成的氢气相同,相同条件下产生氢气的体积关系为①>②=③,
故答案为:①>②=③.
点评 本题考查酸碱混合溶液定性判断,侧重考查学生分析、推断能力,明确一元酸、二元酸和碱的定量关系是解本题关键,题目难度中等,侧重于考查学生的分析能力和应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl NaBr NaI | B. | NaCl NaBr | C. | NaCl NaI | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.4g乙醛所含σ键数目为0.7NA | |
| B. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| C. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| D. | 50ml浓度为18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中不存在一水合氨分子 | |
| B. | 稀释pH=3的醋酸,溶液中所有离子浓度均降低 | |
| C. | 常温下,pH均为10的NaOH溶液和NaCN溶液中,由水电离出来的H+浓度相等 | |
| D. | 向氢氧化镁的悬浊液中加少量的水,平衡向溶解方向移动且c(Mg2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
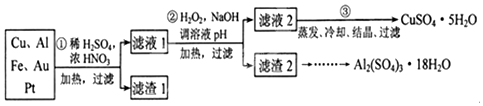
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体中分散质粒子的直径大于溶液中分散质的粒子直径 | |
| B. | 向饱和的氯化铁溶液中加入氢氧化钠溶液得到红褐色沉淀 | |
| C. | 明矾【KAl(SO4)2•12H2O】可以做净水剂 | |
| D. | 氢氧化铁溶胶、稀豆浆、云雾等均具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:K+、Fe3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、[Al(OH)4]-、CO32- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol/L的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com