
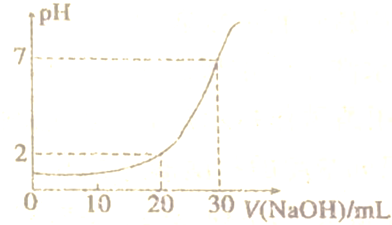
分析 设盐酸、氢氧化钠溶液的物质的量浓度分别为c(HCl)、c(NaOH),当NaOH溶液体积为20mL,利用关系式HCl~NaOH结合图象可知,酸过量,c(H+)=$\frac{10c(HCl)-20c(NaOH)}{30}$=0.01mol/L,当NaOH溶液体积为30mL,利用关系式HCl~NaOH,结合图象可知,溶液呈中性,恰好反应,即10c(HCl)=30c(NaOH),联立方程组计算,据此解答(1)(2);
(3)根据n=cV分别计算出氯化氢、氢氧化钠的物质的量,然后计算出混合液中氢离子浓度,最后计算出混合液的pH;
(4)根据中和滴定中正确的操作方法解答.
解答 解:设该盐酸、NaOH溶液的物质的量浓度分别为c(HCl)、c(NaOH),
当NaOH溶液体积为20mL,结合图象可知,酸过量,则:c(H+)=$\frac{10c(HCl)-20c(NaOH)}{30}$═0.01mol/L ①,
当NaOH溶液体积为30mL,结合图象可知,溶液呈中性,恰好反应,即:10C(HCl)=30c(NaOH)②,
由①②联立解得:c(HCl)=0.09mol/L、c(NaOH)=0.03mol/L,
(1)根据计算可知,该盐酸的浓度为0.09mol/L,
故答案为:0.09mol/L;
(2)根据以上计算可知,该氢氧化钠溶液的物质的量浓度为:0.03mol/L,
故答案为:0.03mol/L;
(3)当滴加NaOH溶液至26mL时,根据图象可知,混合液一定为酸性,则混合液中氢离子浓度为:$\frac{0.09mol/L×0.01L-0.03mol/L×0.026L}{0.01L+0.026L}$=$\frac{1}{3}$×10-2mol/L,混合液的pH=-lg$\frac{1}{3}$×10-2=2+lg3,
故答案为:2+lg3;
(4)从滴定曲线中pH变化可知,中和滴定的速度只能是先快后慢,不能成线流,否则过量一滴引起的pH变化很大,
故答案为:先快后慢,不能成线流;很大.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的表达式及计算方法,试题侧重考查学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.
电解原理在化学工业中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙 | |
| B. | 对苯二甲酸(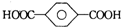 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (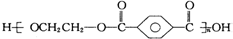 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. | 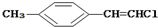 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
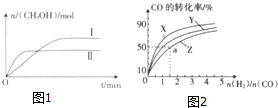 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
② ③
③ ④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
| A. | ④和⑧ | B. | ①②和③ | C. | ⑦和⑧ | D. | ④⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 镁型和铜型的原子堆积方式空间利用率最高 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 温度升高,金属的导电性将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由图象Ⅰ可知,该反应在T1、T3处达到平衡 | |
| B. | 由图象Ⅰ可知,该反应的△H>0 | |
| C. | 图象Ⅱ发生反应的化学方程式为2X+6Y?3Z | |
| D. | 由图象Ⅱ可知,相同条件下起始时投入0.1mol•L-1 Y、0.3mol•L-1 Z和0.4mol•L-1 Z反应,达到平衡后,Z的浓度为0.4mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com