
| 温度/℃ | 30 | 50 | 70 |
| H3BO3物质的量/mol | 1 | 0.8 | 0.4 |

| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| 0.035mol/L |
| 0.7mol/L |
| 0.2×0.2 |
| 0.4×0.1 |
| 0.035mol/L |
| 0.7mol/L |
| 7.0×10-5×7.0×10-5 |
| 0.7 |
| 0.2×0.2 |
| 0.4×0.1 |
| x×x |
| (0.3-x)(0.6-x) |


科目:高中化学 来源: 题型:
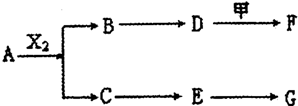
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H20分子的比例模型 |
| B、H20和D2O互为同分异构体 |
| C、H2O分子和H2O2分子都含有极性共价键和非极性共价键 |
| D、H2O沸点高于H2S,是因为H2O分子间存在氢键作用,而H2S分子间 不存在氢键作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10-10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,48gO2和O3的混合气体中含有O原子数为3NA | ||
B、8.4gNaHCO3晶体中含有C
| ||
| C、将0.1mol氯化铝溶于1L水中,所得溶液含有Al3+数为0.1NA | ||
| D、1mol氯气被FeBr2溶液完全吸收,转移的电子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 相关实验 | 预期目的 | |
| A | 相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应 | 探究接触面积对化学反应速率的影响 |
| B | 把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 | 探究蔗糖水解产物具有还原性 |
| D | 两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入MnO2固体 | 探究MnO2固体对H2O2分解速率的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
 ,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于物质A的一种制备方法及由A引发的一系列化学反应.
,物质A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于物质A的一种制备方法及由A引发的一系列化学反应.
 (含结构),它的结构简式为
(含结构),它的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com